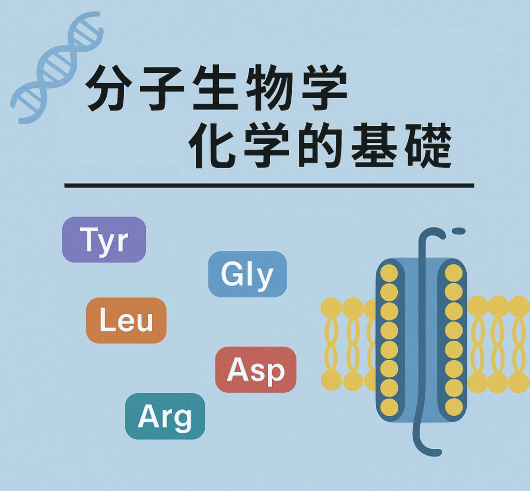
- K⁺チャネルは膜貫通タンパク質(細胞膜のリン脂質二重層を貫通するタンパク質)の一例です。このタンパク質の以下の各領域には、どのようなアミノ酸が含まれていると考えられますか?(a) K⁺が通過する中央の穴の壁、(b) 脂肪酸を含むリン脂質二重層の疎水性中心に接する部分、(c) 細胞質に接する部分、(d) 細胞外に伸びる部分。
- V-M-Y-F-E-Nは、ペプチドのアミノ酸配列を表す1文字コードです。このペプチドのpH 7.0における正味電荷はいくらですか?チロシンキナーゼと呼ばれる酵素は、チロシンの水酸基にリン酸を付加することができます。このチロシンキナーゼの作用後、pH 7.0におけるタンパク質の正味電荷はいくらですか?この酵素がリン酸化に用いるリン酸はどこから来るのでしょうか?
- ジスルフィド結合はタンパク質の三次元構造を安定化させます。ジスルフィド結合の形成に関与するアミノ酸はどれですか?ジスルフィド結合が形成されると、エントロピーΔSは増加しますか、それとも減少しますか?
- 1960年代、サリドマイドは妊婦のつわり治療薬として処方されていました。しかし、服用した女性から生まれた赤ちゃんに重度の四肢欠損が生じたため、つわりへの使用は中止されました。現在では、使用されたサリドマイドは2つの立体異性体の混合物であり、そのうちの1つはつわりの治療に効果があり、もう1つは先天性欠損症を引き起こすことが分かっています。立体異性体とは何でしょうか?なぜ、非常によく似た化合物が、これほど異なる生理作用を示すのでしょうか?
- 血液型は赤血球表面の糖鎖によって決定されます。糖鎖は多様な構造を形成する可能性を秘めています。実際、4種類の糖から構成されるオリゴ糖の複雑さは、4種類のアミノ酸から構成されるオリゴペプチドの多様性よりも大きいのです。糖鎖のこのような多様性は、なぜ生まれるのでしょうか?
- アンモニア(NH3)は弱塩基であり、酸性条件下ではHと結合してアンモニウムイオンを形成します:NH3 + H+ → NH4+ 。NH3は生体膜を自由に通過しますが、リソソーム膜も例外ではありません。リソソームはpHが約4.5~5.0の細胞小器官であり、細胞質のpHは約7.0です。細胞がアンモニアにさらされると、リソソーム内の液体のpHはどのような影響を受けるのでしょうか?ただし、H+と結合したアンモニアは膜を自由に通過しないことに注意してください。
- 結合反応L + R → LRを考えてみましょう。Lはリガンド、Rはその受容体です。1×10-3MのLを5×10-2MのRを含む溶液に加えると、Lの90%が結合してLRを形成します。この反応のKeqはいくらでしょうか?この結合反応を触媒するタンパク質を添加した場合、Keqはどのように変化しますか?この反応のKdはいくらでしょうか?
- 細胞質内のリン酸の解離状態はどのようになっていますか? また、リン酸が生理的に重要な化合物であるのはなぜですか?
- X + Y → XY 反応の ΔG° は -1000 cal/mol です。X、Y、XY が 25°C (298 K) ですべて 0.01 M の場合、ΔG はいくらですか?この反応をエネルギー的に有利にする 2 つの方法を提案してください。
- 健康専門家は、動物性脂肪由来の飽和脂肪酸が冠動脈疾患の主な原因であると考えています。飽和脂肪酸と不飽和脂肪酸の違いは何でしょうか?また、「飽和」とはどういう意味でしょうか?近年、トランス不飽和脂肪酸、すなわちトランス脂肪酸が体内の総コレステロール値を上昇させることが示唆されており、心臓病の一因となる可能性も指摘されています。シス立体異性体はトランス配座とどのように異なるのでしょうか?また、シス配座は脂肪酸鎖の構造にどのような影響を与えるのでしょうか?
- アミノ酸の化学修飾は、タンパク質の多様性と機能に貢献しています。例えば、生体内でタンパク質を活性化するには、特定のアミノ酸のγ-カルボキシル化が必要です。どのようなアミノ酸がこの修飾を受け、この修飾は生体にとってどのような意義を持つのでしょうか?クマリン誘導体であるワルファリンは多くの植物に含まれており、これらのアミノ酸のγ-カルボキシル化を阻害します。かつては殺鼠剤として使用されてきました。現在では、ヒトの臨床治療にも使用されています。ワルファリンはどのような疾患に処方され、その理由は何でしょうか?
K⁺チャネルは膜貫通タンパク質(細胞膜のリン脂質二重層を貫通するタンパク質)の一例です。このタンパク質の以下の各領域には、どのようなアミノ酸が含まれていると考えられますか?(a) K⁺が通過する中央の穴の壁、(b) 脂肪酸を含むリン脂質二重層の疎水性中心に接する部分、(c) 細胞質に接する部分、(d) 細胞外に伸びる部分。
K⁺チャネルの各部位に存在するアミノ酸の特徴
K⁺チャネルは、細胞膜を貫通するタンパク質で、異なる部位ごとに特徴的なアミノ酸が配置されています。下記のように分類できます。
(a) K⁺が通過する中央の穴の壁
- 親水性アミノ酸・極性アミノ酸が多い
- 例:グリシン(Gly)、チロシン(Tyr)、スレオニン(Thr)、セリン(Ser)など
- 特に「GYG」モチーフ(グリシン-チロシン-グリシン)はK⁺チャネルの選択フィルターに保存されており、K⁺イオンと結合しやすい構造を作ります。
- これらのアミノ酸はK⁺イオンの水和シェルを模倣し、イオンがスムーズに通過できるようにします。
(b) 脂肪酸を含むリン脂質二重層の疎水性中心部と接触する部分
- 疎水性アミノ酸が多い
- 例:ロイシン(Leu)、イソロイシン(Ile)、バリン(Val)、フェニルアラニン(Phe)、アラニン(Ala)、メチオニン(Met)など
- 膜貫通領域(αヘリックス構造)は、これらの疎水性アミノ酸が連なり、脂質二重層の疎水性部分と安定して相互作用します。
(c) 細胞質に接する部分
- 親水性アミノ酸や荷電アミノ酸が多い
- 例:アルギニン(Arg)、リシン(Lys)、アスパラギン酸(Asp)、グルタミン酸(Glu)、セリン(Ser)、スレオニン(Thr)など
- 細胞質は水に富んだ環境なので、親水性や負・正に帯電したアミノ酸が多く露出しています。
(d) 細胞外に出ている部分
- 親水性アミノ酸や荷電アミノ酸が多い
まとめ表
| 部位 | 主なアミノ酸の特徴 | 具体例 |
|---|---|---|
| (a) 中央の穴の壁 | 親水性・極性 | Gly, Tyr, Thr, Ser など |
| (b) 膜貫通部 | 疎水性 | Leu, Ile, Val, Phe, Ala, Met など |
| (c) 細胞質側 | 親水性・荷電 | Arg, Lys, Asp, Glu, Ser, Thr など |
| (d) 細胞外側 | 親水性・荷電 | Arg, Lys, Asp, Glu, Ser など |
このように、K⁺チャネルはその構造と機能に応じて、部位ごとに適したアミノ酸が配置されています。
V-M-Y-F-E-Nは、ペプチドのアミノ酸配列を表す1文字コードです。このペプチドのpH 7.0における正味電荷はいくらですか?チロシンキナーゼと呼ばれる酵素は、チロシンの水酸基にリン酸を付加することができます。このチロシンキナーゼの作用後、pH 7.0におけるタンパク質の正味電荷はいくらですか?この酵素がリン酸化に用いるリン酸はどこから来るのでしょうか?
V-M-Y-F-E-Nは、あるペプチドのアミノ酸の配列を一文字表記で示したものである。pH7.0でこのペプチドの正味の電荷はいくつか、チロシンキナーゼという酵素はチロシンのヒドロキシ基にリン酸を結合できる。このチロシンキナーゼを作用させた後、タンパク質のpH7.0での正味の電荷はどれだけか。この酵素がリン酸化に使うリン酸は、どこからくるか。
V-M-Y-F-E-Nペプチドの電荷とリン酸化
1. pH7.0での正味の電荷
- アミノ酸配列: V(バリン)- M(メチオニン)- Y(チロシン)- F(フェニルアラニン)- E(グルタミン酸)- N(アスパラギン)
- N末端(アミノ基): +1
- C末端(カルボキシル基): -1
- 各アミノ酸側鎖の電荷:
- V, M, Y, F, N:0(中性)
- E:-1(グルタミン酸はpH7で負電荷)
計算式:
+1 (N末端)+0 (V)+0 (M)+0 (Y)+0 (F)+(−1) (E)+0 (N)+(−1) (C末端)=−1
- 正味の電荷:-1
2. チロシンキナーゼ作用後の電荷
- チロシン(Y)のヒドロキシ基にリン酸基(-PO₃²⁻)が付加されると、リン酸基はpH7.0で約-2の電荷を持つ。
- よって、リン酸化により正味の電荷がさらに-2される。
計算式:−1 (リン酸化前)+(−2)=−3−1 (リン酸化前)+(−2)=−3
- リン酸化後の正味の電荷:-3
3. リン酸の供給源
- **チロシンキナーゼが利用するリン酸は、ATP(アデノシン三リン酸)**から供給される。
- ATPがADP(アデノシン二リン酸)に分解される際に、リン酸基(Pi)がチロシンに転移される。
まとめ表
| 状態 | 正味の電荷 |
|---|---|
| リン酸化前 | -1 |
| リン酸化後 | -3 |
- リン酸基はATPから供給される。
- リン酸化により電荷は-2増加する(より負になる)。
このように、酵素によるリン酸化はタンパク質の電荷や機能に大きな影響を与えます。
ジスルフィド結合はタンパク質の三次元構造を安定化させます。ジスルフィド結合の形成に関与するアミノ酸はどれですか?ジスルフィド結合が形成されると、エントロピーΔSは増加しますか、それとも減少しますか?
ジスルフィド結合に関与するアミノ酸
- **システイン(Cysteine, Cys, C)**がジスルフィド結合の形成に関与します。
- 2つのシステイン残基の側鎖(-SH基)が酸化されて**ジスルフィド結合(-S-S-)**を形成します。
- この結合はタンパク質の三次構造や四次構造を安定化させる重要な役割を持ちます。
ジスルフィド結合形成とエントロピー(ΔS)
- ジスルフィド結合が形成されると、2つのシステイン残基が共有結合でつながり、タンパク質分子内の自由度が減少します。
- これは、分子の構造がより制限されることを意味し、エントロピー(ΔS)は減少します(ΔS < 0)。
- エントロピーの減少は、分子の無秩序さやランダム性が減ることを示します。
ポイントまとめ
| 項目 | 内容 |
|---|---|
| 関与するアミノ酸 | システイン(Cys) |
| エントロピーの変化 | 減少する(ΔS < 0) |
- ジスルフィド結合はシステイン同士の-SH基の酸化によってでき、タンパク質の立体構造を安定化させます。
- 結合形成により分子の自由度が減るため、エントロピーは減少します。
1960年代、サリドマイドは妊婦のつわり治療薬として処方されていました。しかし、服用した女性から生まれた赤ちゃんに重度の四肢欠損が生じたため、つわりへの使用は中止されました。現在では、使用されたサリドマイドは2つの立体異性体の混合物であり、そのうちの1つはつわりの治療に効果があり、もう1つは先天性欠損症を引き起こすことが分かっています。立体異性体とは何でしょうか?なぜ、非常によく似た化合物が、これほど異なる生理作用を示すのでしょうか?
立体異性体とは何か
- **立体異性体(ステレオイソマー)**とは、同じ分子式・原子の結合順序を持ちながら、原子の空間的な配置が異なる化合物です。
- サリドマイドのように「不斉炭素原子(4つの異なる原子や基が結合した炭素)」を持つ分子は、右手と左手のように互いに鏡像関係にある2種類の異性体(鏡像異性体=エナンチオマー)を作ります。
- サリドマイドの場合、R体(右手型)とS体(左手型)の2つの鏡像異性体が存在します。
サリドマイド事件と異性体の違い
- 1960年代、サリドマイドはつわりなどの治療薬として使われましたが、服用した妊婦の子どもに重い四肢障害(アザラシ肢症など)が多発し、社会問題となりました。
- 当時使われたサリドマイドは、**R体とS体の混合物(ラセミ体)**でした。
- R体:つわりなどへの効果(鎮静・睡眠作用)を持つ。
- S体:胎児に対して催奇形性(先天異常を引き起こす作用)を持つ。
立体異性体で生理的効果が異なる理由
- 生体内の酵素や受容体などの多くは「キラル(立体的な形を持つ)」なため、鏡像異性体ごとに反応性や作用が大きく異なります。
- たとえば、右手用の手袋は左手には合わないように、R体とS体は生体分子との「かみ合わせ」が異なるため、全く違う生理作用を示します。
- サリドマイドの場合、R体はつわりに有効ですが、S体は胎児の発生に関わるタンパク質と特異的に結合し、四肢の発育障害を引き起こすことが分かっています。
なぜ混合物が使われたのか
- 当時は鏡像異性体ごとに分離して薬を作る技術が未発達でした。
- さらに、サリドマイドは体内でR体とS体が互いに変化(ラセミ化)しやすい性質があり、仮にR体だけを投与しても体内でS体が生じてしまうため、薬害を防ぐことはできませんでした。
まとめ表
| 異性体 | 主な作用 | 安全性 |
|---|---|---|
| R体 | 鎮静・睡眠作用 | 比較的安全 |
| S体 | 催奇形性(先天異常) | 危険 |
ポイント
- **立体異性体**は、原子の並びは同じでも立体配置が異なる化合物。
- 生体は立体構造を認識するため、わずかな構造の違いで全く異なる作用や毒性を示すことがある。
- サリドマイド事件は、薬の立体異性体の重要性と、生体との相互作用の精密さを示す代表例です。
血液型は赤血球表面の糖鎖によって決定されます。糖鎖は多様な構造を形成する可能性を秘めています。実際、4種類の糖から構成されるオリゴ糖の複雑さは、4種類のアミノ酸から構成されるオリゴペプチドの多様性よりも大きいのです。糖鎖のこのような多様性は、なぜ生まれるのでしょうか?
糖鎖の多様性の起因
糖鎖(グリカン)は、赤血球の血液型を決めるだけでなく、生体内で多様な機能を担っています。その多様性は、同じ数のアミノ酸からできるオリゴペプチドよりもはるかに高い複雑さを持ちます。この理由は、糖鎖が持つ結合の自由度と構造の多様性にあります。
1. 結合様式の多様性
- 分岐構造が可能
アミノ酸や核酸は直鎖状につながりますが、糖鎖は**分岐(ブランチ)**した構造をとることができます。 - 結合位置の多様性
単糖分子には複数の水酸基(-OH)があり、どの位置で他の糖と結合するかによって多くの異なる構造が生まれます。 - 結合の立体化学(α/β結合)
同じ位置で結合しても、α型とβ型という異なる立体配置が存在し、これも多様性を増やします。
2. 構成単糖の種類と配列
- 複数種類の単糖
生体内で使われる単糖は10種類以上あり、それぞれが異なる組み合わせや順序で連結されます。 - 配列順序の自由度
同じ4種類の単糖でも、その並び順や結合方法の違いで膨大なバリエーションが生じます。
3. 翻訳後修飾や酵素活性
- 糖転移酵素の多様性
糖鎖は、糖転移酵素の働きによって細胞ごとに異なるパターンで修飾されます。これが細胞ごとの個性や機能の違いを生み出します。 - 生合成経路の複雑さ
糖鎖の合成は一方向ではなく、多段階で分岐した経路をたどるため、結果として多様な構造が生じます。
まとめ表
| 多様性の要因 | 内容 |
|---|---|
| 分岐構造 | 直鎖だけでなく分岐した構造をとることができる |
| 結合位置 | 複数の水酸基で結合できるため、結合パターンが多い |
| α/β結合 | 同じ位置でも立体異性体(α型・β型)が存在 |
| 単糖の種類・配列 | 多種類の単糖と並び順・結合順序の違い |
| 酵素による修飾 | 糖転移酵素の違いによって細胞ごとに異なる糖鎖が形成される |
ポイント
- 糖鎖の多様性は、分岐・結合様式・立体化学・単糖の種類・酵素修飾が組み合わさることで生まれる。
- 同じ数のアミノ酸からできるペプチドよりも、はるかに多くの構造バリエーションを持つ。
このため、糖鎖は生体内で非常に多様な役割を果たし、血液型だけでなく細胞認識やシグナル伝達などにも関与しています。
アンモニア(NH3)は弱塩基であり、酸性条件下ではHと結合してアンモニウムイオンを形成します:NH3 + H+ → NH4+ 。NH3は生体膜を自由に通過しますが、リソソーム膜も例外ではありません。リソソームはpHが約4.5~5.0の細胞小器官であり、細胞質のpHは約7.0です。細胞がアンモニアにさらされると、リソソーム内の液体のpHはどのような影響を受けるのでしょうか?ただし、H+と結合したアンモニアは膜を自由に通過しないことに注意してください。
アンモニア曝露時のリソソーム内での現象
- NH₃の膜通過
細胞外や細胞質にアンモニア(NH₃)が存在すると、NH₃は濃度勾配に従ってリソソーム膜を通過し、リソソーム内部に入ります。 - リソソーム内でのプロトン結合
リソソーム内部は酸性のため、NH₃はH⁺(プロトン)と結合してNH₄⁺となります。NH3+H+→NH4+NH3+H+→NH4+ - NH₄⁺の膜透過性
生成したNH₄⁺は膜を自由に通過できないため、リソソーム内に「H⁺を消費したNH₄⁺」が蓄積します。 - pHの上昇(アルカリ化)
NH₃がH⁺を奪うことで、リソソーム内のプロトン濃度(=酸性度)が低下し、pHが上昇します(アルカリ化)。
まとめ表
| 状態 | リソソーム内pH | 備考 |
|---|---|---|
| 通常(アンモニアなし) | 4.5~5.0 | 酸性、酵素活性が高い |
| アンモニア曝露時 | 5.5~6.2程度 | アルカリ化、酵素活性が低下 |
ポイント
- NH₃はリソソーム膜を通過し、内部でH⁺と結合してNH₄⁺となる。
- この過程でリソソーム内のH⁺が減少し、pHが上昇(アルカリ化)する。
- NH₄⁺は膜を通過しにくいため、pH上昇が持続する。
この現象は、細胞のアンモニア応答やリソソーム機能障害のメカニズム理解に重要です。
結合反応L + R → LRを考えてみましょう。Lはリガンド、Rはその受容体です。1×10-3MのLを5×10-2MのRを含む溶液に加えると、Lの90%が結合してLRを形成します。この反応のKeqはいくらでしょうか?この結合反応を触媒するタンパク質を添加した場合、Keqはどのように変化しますか?この反応のKdはいくらでしょうか?
1. 平衡定数(Keq)の計算
反応式:
\( \mathrm{L} + \mathrm{R} \rightleftharpoons \mathrm{LR} \)
平衡定数の定義:
\( K_{\mathrm{eq}} = \frac{[\mathrm{LR}]}{[\mathrm{L}][\mathrm{R}]} \)
与えられた値:
- \( [\mathrm{L}] = 1 \times 10^{-4} \, \mathrm{M} \)
- \( [\mathrm{R}] = 4.91 \times 10^{-2} \, \mathrm{M} \)
- \( [\mathrm{LR}] = 9 \times 10^{-4} \, \mathrm{M} \)
平衡定数の計算:
\( K_{\mathrm{eq}} = \frac{9 \times 10^{-4}}{(1 \times 10^{-4})(4.91 \times 10^{-2})} \approx 183 \)
解離定数(\( K_d \))の定義と計算:
\( K_d = \frac{1}{K_{\mathrm{eq}}} = \frac{1}{183} \approx 5.46 \times 10^{-3} \, \mathrm{M} \)
2. 触媒タンパク質添加時のKeqの変化
- 触媒(酵素)は反応の速度を上げるが、平衡定数(Keq)自体は変化しません。
- 触媒は反応の進行を速くするだけで、最終的な平衡状態(Keq)は変わりません。
3. Kd(解離定数)とは
- Kd(解離定数)は、結合体(LR)がどれだけ解離しやすいかを示す値です。
- 定義式:Kd=[L][R][LR]Kd=[LR][L][R]
- Keqと逆数の関係にあります:Kd=1KeqKd=Keq1
- **Kdが小さいほど、LとRの結合が強い**ことを意味します。
まとめ表
| 項目 | 内容 |
|---|---|
| Keq | 約183 |
| 触媒添加時のKeq | 変化しない |
| Kd | Kd=1/Keq(結合の弱さを示す) |
ポイント:
- Keqは結合の強さを示し、触媒はKeq自体には影響しません。
- KdはKeqの逆数で、値が小さいほど結合が強固です。
細胞質内のリン酸の解離状態はどのようになっていますか? また、リン酸が生理的に重要な化合物であるのはなぜですか?
細胞質中でのリン酸の解離状態
細胞質内のpHはおよそ7.0前後(中性付近)です。この環境下で存在する無機リン酸(Pi)は、主に次の2つの形で解離しています。
- H₂PO₄⁻(二水素リン酸イオン)
- HPO₄²⁻(一水素リン酸イオン)
生理的pH(約7.0~7.4)では、H₂PO₄⁻とHPO₄²⁻がほぼ1:4程度の比率で共存しており、HPO₄²⁻の方がやや多い状態です。これはリン酸のpKa2(約7.2)に由来し、細胞質のpHにおいて両者がバッファーとして機能するためです。
まとめ表
| pH | 主なリン酸イオンの形態 | 比率(概算) |
|---|---|---|
| 7.0 | H₂PO₄⁻, HPO₄²⁻ | 1 : 4 |
リン酸が生理的に重要な理由
リン酸は生体内で極めて多様かつ重要な役割を果たしています。
1. エネルギー代謝の中心
- **ATP(アデノシン三リン酸)**などの高エネルギーリン酸化合物は、細胞のエネルギー通貨として機能します。
- ATPの加水分解や再合成を通じて、ほぼすべての生命活動にエネルギーを供給します。
2. 骨や歯の構成成分
- 骨や歯の主成分であるハイドロキシアパタイトは、カルシウムとリン酸から構成されています。
- リン酸が不足すると、骨の発育障害や骨軟化症(くる病・骨軟化症)を引き起こします。
3. 核酸や細胞膜の構成
- **DNAやRNA**の骨格はリン酸エステル結合でつながっています。
- **細胞膜**の主成分であるリン脂質もリン酸を含み、細胞の構造や機能維持に不可欠です。
4. シグナル伝達・酵素調節
- **タンパク質のリン酸化(リン酸基の付加・除去)**は、細胞内シグナル伝達や酵素活性の調節において中心的な役割を果たします。
- 無機リン酸自体も、細胞内外の情報伝達や代謝経路の制御に関与しています。
5. 酸塩基バランスの維持
- リン酸は生体内の緩衝系(バッファー)として、細胞質や血液のpHを安定に保つ働きがあります。
ポイントまとめ
- 細胞質中では、リン酸は主にH₂PO₄⁻とHPO₄²⁻の形で存在し、バッファーとしても機能する。
- リン酸はエネルギー代謝、骨・歯の構成、核酸・膜の形成、シグナル伝達、pH調節など多岐にわたり生理的に不可欠な化合物である。
ΔGの計算 反応式:X + Y → XY 反応の ΔG° は -1000 cal/mol です。X、Y、XY が 25°C (298 K) ですべて 0.01 M の場合、ΔG はいくらですか?この反応をエネルギー的に有利にする 2 つの方法を提案してください。
X + Y → XY
- 標準ギブズ自由エネルギー変化(ΔG°):-1000 cal/mol
- 温度:25°C(298K)
- 各成分の濃度:[X] = [Y] = [XY] = 0.01 M
ΔGの計算式:
ΔG = ΔG° + RT ln ( [XY] / ([X][Y]) )
各値:
- R = 1.987 cal/(mol·K)
- T = 298 K
- Q = [XY] / ([X][Y]) = 0.01 / (0.01 × 0.01) = 100
- ln Q = ln 100 ≈ 4.605
計算:
ΔG = -1000 + (1.987 × 298) × 4.605 ΔG ≈ -1000 + 592.126 × 4.605 ΔG ≈ -1000 + 2726.84 = 1726.84 cal/mol
答え:
この条件でのΔGは 約+1727 cal/mol(正の値、非自発的)
- XまたはYの濃度を増やす
反応物(XまたはY)の濃度を高くすると、[XY]/([X][Y])の値が小さくなり、lnの項が負になってΔGが低下(反応が有利)します。 - 生成物(XY)の濃度を下げる
反応が進行するにつれて生成物(XY)を系外に除去する、または消費することで、Q値が小さくなり、ΔGが負方向に傾きます。
| 方法 | 具体例・効果 |
|---|---|
| XまたはYの濃度を上げる | 反応物を多く加えるとΔGが下がり有利になる |
| XYの濃度を下げる | 生成物を除去・消費するとΔGが下がり有利になる |
ΔGが負になるほど反応は自発的に進行しやすくなります。
健康専門家は、動物性脂肪由来の飽和脂肪酸が冠動脈疾患の主な原因であると考えています。飽和脂肪酸と不飽和脂肪酸の違いは何でしょうか?また、「飽和」とはどういう意味でしょうか?近年、トランス不飽和脂肪酸、すなわちトランス脂肪酸が体内の総コレステロール値を上昇させることが示唆されており、心臓病の一因となる可能性も指摘されています。シス立体異性体はトランス配座とどのように異なるのでしょうか?また、シス配座は脂肪酸鎖の構造にどのような影響を与えるのでしょうか?
1. 飽和脂肪酸を不飽和脂肪酸から区別するもの
- 飽和脂肪酸は、炭素鎖のすべての炭素が水素で「飽和」されており、炭素同士の間に二重結合がないのが特徴です。
- 不飽和脂肪酸は、炭素鎖に一つ以上の二重結合が含まれています。
| 種類 | 二重結合 | 例 |
|---|---|---|
| 飽和脂肪酸 | なし | パルミチン酸、ステアリン酸 |
| 不飽和脂肪酸 | あり | オレイン酸、リノール酸 |
2. 「飽和」という言葉の意味
- 「飽和」とは、脂肪酸の炭素鎖が水素原子で最大限に満たされている状態を指します。
- つまり、炭素同士の間に二重結合がなく、すべて単結合でつながっているため、これ以上水素が付加できない構造です。
3. シス形とトランス形の違い
- シス形(cis型):二重結合の両側にある水素原子が同じ側に位置している。
- トランス形(trans型):二重結合の両側にある水素原子が反対側に位置している。
| 異性体 | 水素の位置 | 立体構造の特徴 |
|---|---|---|
| シス | 同じ側 | 曲がった(折れた)鎖 |
| トランス | 反対側 | 直線的な(伸びた)鎖 |
4. シス形構造が脂肪酸鎖に与える影響
- **シス形構造は脂肪酸鎖に「折れ曲がり」**を生じさせます。
- この折れ曲がりにより、脂肪酸同士が密に並ぶことができず、常温で液体(油)になりやすいです(例:オリーブオイル)。
- 一方、トランス形構造は鎖が直線的になるため、脂肪酸同士が密に並びやすく、常温で固体(マーガリンなど)になりやすいです。
まとめ
- **飽和脂肪酸**は二重結合がなく、炭素鎖が水素で「飽和」されている。
- **不飽和脂肪酸**は一つ以上の二重結合を持つ。
- **シス形**は脂肪酸鎖を折れ曲げ、液体の油になりやすい。
- **トランス形**は直線的で固体脂肪になりやすく、健康への悪影響が指摘されている。
- トランス脂肪酸や飽和脂肪酸の過剰摂取は、コレステロール値を上げ、心臓疾患のリスクを高めると考えられている。
アミノ酸の化学修飾は、タンパク質の多様性と機能に貢献しています。例えば、生体内でタンパク質を活性化するには、特定のアミノ酸のγ-カルボキシル化が必要です。どのようなアミノ酸がこの修飾を受け、この修飾は生体にとってどのような意義を持つのでしょうか?クマリン誘導体であるワルファリンは多くの植物に含まれており、これらのアミノ酸のγ-カルボキシル化を阻害します。かつては殺鼠剤として使用されてきました。現在では、ヒトの臨床治療にも使用されています。ワルファリンはどのような疾患に処方され、その理由は何でしょうか?
γ-カルボキシル化を受けるアミノ酸
- **グルタミン酸(Glutamic acid, Glu, E)**がγ-カルボキシル化(より正確には「γ-カルボキシグルタミン酸化」)を受ける代表的なアミノ酸です。
- この修飾によって、グルタミン酸の側鎖にもう1つカルボキシル基(-COOH)が付加され、「γ-カルボキシグルタミン酸(Gla)」残基となります。
γ-カルボキシル化の生物学的な意義
- 血液凝固因子の活性化
γ-カルボキシル化は、血液凝固因子(プロトロンビン、第VII、IX、X因子など)の活性化に不可欠です。Gla残基はカルシウムイオン(Ca²⁺)と強く結合し、凝固因子が血小板や細胞膜表面に結合できるようにします。これが正常な止血反応に必須です。 - 骨や他の組織のタンパク質にも重要
骨のオステオカルシンや、他のGlaタンパク質にも同様の修飾があり、カルシウム代謝や骨の形成に関与しています。
ワルファリンの作用と臨床応用
- ワルファリンはビタミンKの働きを阻害し、グルタミン酸のγ-カルボキシル化を妨げます。
- これにより、血液凝固因子が活性化されず、血液が固まりにくくなります。
主な適応疾患とその理由
| 病気・状態 | ワルファリンが使われる理由 |
|---|---|
| 心房細動 | 心房内で血栓ができやすく、脳梗塞などの塞栓症を予防するため |
| 人工心臓弁置換後 | 弁の周囲で血栓ができやすいため、その予防 |
| 深部静脈血栓症(DVT) | 下肢などの静脈に血栓ができやすく、肺塞栓など重篤な合併症を防ぐため |
| 肺塞栓症(PE) | 血栓が肺動脈に詰まるのを防ぐため |
| その他 | 心筋梗塞後の血栓予防、抗リン脂質抗体症候群など |
- なぜ使われるか
これらの病気は、血液が固まりやすい状態(血栓リスクが高い状態)で、血栓ができると脳梗塞や肺塞栓など命に関わる合併症を引き起こすため、ワルファリンで血液凝固を抑制し、血栓を予防します。
まとめ
- γ-カルボキシル化は主にグルタミン酸残基に起こり、血液凝固や骨代謝に不可欠な修飾です。
- ワルファリンはこの修飾を阻害し、血液凝固を抑制します。
- ヒトでは主に血栓症の予防・治療目的で処方されます。
問題文引用元:東京化学同人 分子細胞生物学 第6版

コメント