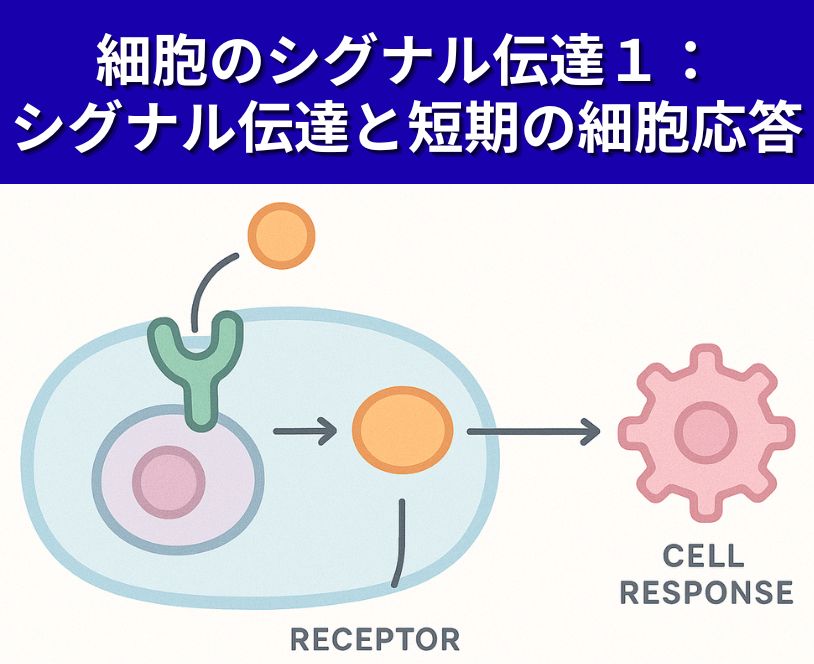
- 異なる細胞のシグナル伝達経路の多くにおいて、共通する特徴は何か。
- 細胞外からの水溶性分子によるシグナル伝達は、内分泌,傍分泌,自己分泌シグナル伝達の三つに分類できる。この三つの細胞間シグナル伝達の違いを説明せよ、成長ホルモンは脳のすぐ下にある脳下垂体から分泌され、肝臓にある成長ホルモン受容体に働きかける。この例は内分泌,傍分泌、あるいは自己分泌シグナル伝達のどれにあたるか。それはなぜか.
- あるリガンドは2種の受容体に対し、受容体1とKd=10-7Mで結合し、受容体2とKd=10-9Mで結合する。リガンドとの親和性が高いのはどちらの受容体か。遊離リガンド濃度が10-8Mのとき、リガンドと結合している受容体の割合([RL]/RT)を受容体1と2のそれぞれについて計算せよ。
- 細胞表面受容体の研究は、単離精製やクローン化技術によって非常に進展した。アフィニティークロマトグラフィーで細胞表面受容体を単離精製する方法を説明せよ。機能発現測定を用いて細胞表面受容体遺伝子をクローン化する方法を説明せよ。
- シグナル伝達を行う三量体Gタンパク質は α,β,γという三つのサブユニットからなる。Gαサブユニットは GTPase 活性をもつスイッチタンパク質で、GTP 結合型か GDP結合型かに依存して活性型あるいは不活性型になる。リガンドの結合が三量体Gタンパク質複合体を介してエフェクタータンパク質を活性化するまでの諸段階を復習せよ。GTPase 活性が通常より高い突然変異Gαサブユニットを単離したとする。この突然変異はGタンパク質とそのエフェクタータンパク質にどのような効果を及ぼすと考えられるか。
- CatやCAMPのような二次メッセンジャーは、どのようにして細胞外シグナルを伝達し増幅できるのかを説明せよ。
- 細菌のコレラ菌が産生するコレラ毒素は、感染した個体に水のような下痢の症状をひき起こす。コレラ毒素によるこの効果の分子機構は何か。
- アドレナリンはアドレナリンβ受容体とアドレナリンα受容体の両方に結合する。アドレナリンがそれら2種類の受容体と結合したときに、エフェクタータンパク質であるアデニル酸シクラーゼに及ぼす効果はどう異なるのか。アドレナリンβ受容体にアゴニストあるいはアンタゴニストを作用させたときに、アデニル酸シクラーゼの活性はそれぞれどうなるか。
- 視覚におけるロドプシンと心筋におけるムスカリン性アセチルコリン受容体は、ともにGタンパク質を介してイオンチャネルと共役している。これらの二つの系の間での類似点と相違点を述べよ。
- Gs タンパク質共役型受容体がリガンドによる刺激を受け続けると、脱感作という現象が起こる。受容体を脱感作させるいくつかの分子機構について述べよ。受容体はどのようにしてもとの感作状態に戻るのか。突然変異によって、リン酸化されるセリンあるいはトレオニンが失われてしまった受容体をもつ細胞の性質はどうなるか。
- 視覚順応と受容体の脱感作には、同じようなリン酸化機構が存在する。これらの過程でアドレナリンβ受容体キナーゼ(BARK)とロドプシンキナーゼが果たす重要な役割について述べよ.これらの反応において脱リン酸の果たす役割は何か。
- しばしば細胞は、シグナル伝達経路の効果を特定の細胞内部位に局在化させることが必要である。その一つの例は、心筋におけるcAMP シグナルの局在化である。どのようなタンパク質が介在しているか。このシステムはどのように機能するか。
- イノシトール 1,4,5ートリスリン酸(IP3)とジアシルグリセロール(DAG)という二つの二次メッセンジャーは、ホスファチジルイノシトール4,5ービスリン酸(PIP2)が活性化されたホスホリパーゼCによって切断されて生成する。小胞体からのCa2+放出におけるIP3の役割について述べよ。細胞はどのようにして小胞体のCa2+貯蔵量を維持するのか。DAGの主要な役割は何か。
- IP3の役割
- 小胞体のCa2+貯蔵量の維持
- DAGの主要な役割
- 最近の研究から、摂食行動と睡眠の間を関連づける驚くべき分子が同定された。両経路によって共有されているかもしれないシグナル伝達因子について述べよ。
異なる細胞のシグナル伝達経路の多くにおいて、共通する特徴は何か。
細胞のシグナル伝達経路は、多様な刺激に応答しますが、多くの経路に共通して以下の特徴があります。
1. 細胞膜や細胞内での「受容体」によるシグナル検出
2. シグナルの階層的な伝達カスケード
- シグナルは複数のタンパク質(例:キナーゼやGタンパク質など)の連鎖的な活性化(リン酸化やGTP化など)を経て強調・増幅され、最終的な細胞応答に至る仕組みが一般的です(MAPキナーゼ経路、JAK-STAT経路など)。
3. シグナルの「増幅」・「調節」・「修飾」
4. タンパク質の「リン酸化」や「脱リン酸化」、「GTP化」などの共有メカニズム
5. 転写因子の活性化・細胞応答の多様性
多くのシグナル伝達経路は、受容体・階層的な伝達・シグナル増幅・タンパク質の修飾・転写調節といった共通要素から構成されており、異なる細胞でも基本的なメカニズムは驚くほど似ています。
細胞外からの水溶性分子によるシグナル伝達は、内分泌,傍分泌,自己分泌シグナル伝達の三つに分類できる。この三つの細胞間シグナル伝達の違いを説明せよ、成長ホルモンは脳のすぐ下にある脳下垂体から分泌され、肝臓にある成長ホルモン受容体に働きかける。この例は内分泌,傍分泌、あるいは自己分泌シグナル伝達のどれにあたるか。それはなぜか.
三つの細胞間シグナル伝達の違い
- 内分泌(エンドクリン)シグナル伝達
分泌細胞がホルモンなどのシグナル分子を血流など体液に放ち、その物質が血液を介して遠く離れた標的細胞に作用するタイプ。全身規模での恒常性維持や成長調節などに使われます。 - 傍分泌(パラクリン)シグナル伝達
分泌細胞から出たシグナル分子が周囲・近傍の細胞に拡散し、ごく近い組織で作用するタイプ。増殖因子やサイトカインなど、組織局所での調節を担います。 - 自己分泌(オートクリン)シグナル伝達
シグナル分子を出した細胞自身がその物質の受容体も持ち、自分自身の増殖や分化などの調節に用いるタイプです。
成長ホルモンの例はどれにあたるか
- 成長ホルモン(GH)は、脳下垂体から血流中に分泌され、遠く離れた肝臓の成長ホルモン受容体に作用します。この例は「内分泌(エンドクリン)シグナル伝達」に該当します。
- 理由は、分泌されたホルモン(GH)が血流を介して遠隔臓器の標的細胞まで運ばれ、標的臓器で特異的な応答を引き起こすという、内分泌型の典型的な挙動を示しているからです。
あるリガンドは2種の受容体に対し、受容体1とKd=10-7Mで結合し、受容体2とKd=10-9Mで結合する。リガンドとの親和性が高いのはどちらの受容体か。遊離リガンド濃度が10-8Mのとき、リガンドと結合している受容体の割合([RL]/RT)を受容体1と2のそれぞれについて計算せよ。
親和性が高いのはどちらの受容体か
- 親和性(=結合力)はKd(解離定数)が小さいほど高くなります。
- 受容体1: Kd = 10^-7 M
- 受容体2: Kd = 10^-9 M
- よって、親和性が高いのは受容体2です。
リガンドと結合している受容体の割合([RL]/RT)の計算
割合の公式:
\[
\frac{[\mathrm{RL}]}{R_T} = \frac{[L]}{[L] + K_d}
\]
- 遊離リガンド濃度 $[L]$=10−8 M
1. 受容体1(Kd=10^-7M)の場合
\[
\frac{[\mathrm{RL}]}{R_T} = \frac{10^{-8}}{10^{-8} + 10^{-7}}
= \frac{10^{-8}}{1.1 \times 10^{-7}}
\approx 0.0909
\]
2. 受容体2(Kd=10^-9M)の場合
\[
\frac{[\mathrm{RL}]}{R_T} = \frac{10^{-8}}{10^{-8} + 10^{-9}}
= \frac{10^{-8}}{1.1 \times 10^{-8}}
\approx 0.909
\]
答えのまとめ
- 親和性が高いのは受容体2(Kdが小さい方)です。
- リガンド濃度が10^-8Mのとき、
- 受容体1の占有率([RL]/RT)は約9.1%
- 受容体2の占有率([RL]/RT)は約90.9% となります。
細胞表面受容体の研究は、単離精製やクローン化技術によって非常に進展した。アフィニティークロマトグラフィーで細胞表面受容体を単離精製する方法を説明せよ。機能発現測定を用いて細胞表面受容体遺伝子をクローン化する方法を説明せよ。
アフィニティークロマトグラフィーによる細胞表面受容体の単離精製方法
- リガンドの固定化
細胞表面受容体が特異的に結合するリガンド(分子)をアフィニティーカラムの固相担体(ビーズなど)に共有結合や非共有結合で固定化します。 - 細胞膜抽出物の通過
細胞膜から膜タンパク質を含む抽出液を作成し、それをこのリガンド固定化カラムに通します。 - 特異的結合と洗浄
目的の受容体は固定化されたリガンドに特異的に結合し、それ以外のタンパク質は洗浄で除去されます。 - 受容体の溶出
結合した受容体を緩衝液の条件変化(pHや塩濃度)や競合的リガンドの添加によって溶出し、純度の高い受容体タンパク質を回収します。
この方法により、受容体の高い特異性と親和性を利用した効率的な単離精製が可能となります。
機能発現測定を用いた細胞表面受容体遺伝子のクローニング方法
- cDNAライブラリー作成
特定組織や細胞からmRNAを抽出し、逆転写してcDNAライブラリーを作成します。 - 発現系への導入
cDNAライブラリーから得られた遺伝子群を、発現可能な宿主細胞(例えば、昆虫細胞、哺乳類細胞、または酵母など)に導入します。 - 機能発現のスクリーニング
発現した遺伝子の中から、目的のリガンドに応答する機能(例:リガンド結合、シグナル伝達活性、細胞応答)を示す細胞を選別します。 - 遺伝子の同定
機能陽性細胞から導入したcDNAを回収し、塩基配列解析により受容体遺伝子を同定します。
この方法は、受容体の機能に基づくスクリーニングであるため、直接受容体遺伝子を特定可能であり、クローン化の有力手法となっています。
このようにアフィニティークロマトグラフィーは受容体タンパク質の純度高い単離に、機能発現測定は受容体遺伝子の機能的同定に利用され、細胞表面受容体研究を大きく進展させました。
シグナル伝達を行う三量体Gタンパク質は α,β,γという三つのサブユニットからなる。Gαサブユニットは GTPase 活性をもつスイッチタンパク質で、GTP 結合型か GDP結合型かに依存して活性型あるいは不活性型になる。リガンドの結合が三量体Gタンパク質複合体を介してエフェクタータンパク質を活性化するまでの諸段階を復習せよ。GTPase 活性が通常より高い突然変異Gαサブユニットを単離したとする。この突然変異はGタンパク質とそのエフェクタータンパク質にどのような効果を及ぼすと考えられるか。
三量体Gタンパク質の活性化シグナル伝達の流れ
- 受容体(GPCR)へのリガンド結合
細胞外のリガンドがGタンパク質共役型受容体(GPCR)に結合することで、GPCRの立体構造が変化します。 - 三量体Gタンパク質の活性化
変化したGPCRがGαサブユニットを刺激し、Gαに結合しているGDPがGDPからGTPに交換されます。これによりGαは活性化されます。 - サブユニットの解離
GTP結合型のGαは、βγサブユニットから離れ、Gα-GTPと自由なβγサブユニットが単独で働き始めます。 - エフェクターの活性化
Gα-GTPやβγサブユニットはそれぞれが結合するエフェクタータンパク質(アデニル酸シクラーゼやフォスホリパーゼなど)を活性化し、細胞内にシグナルを伝達します。 - シグナルの消散
Gαサブユニットは内在するGTPase活性によりGTPをGDPへと加水分解し、不活性型に戻ります。このGDP結合型のGαはβγサブユニットと再結合し、三量体Gタンパク質の状態に復帰します。
GTPase活性が通常より高い突然変異Gαサブユニットの影響
- GTPの加水分解(GTPase活性)が亢進するため、Gαはより速やかにGDP結合型の不活性状態に戻る。
- その結果、Gαが活性型としてエフェクターを活性化する時間が短縮され、細胞内シグナルの強度や持続時間が減少する。
- したがって、この突然変異はエフェクターの活性化が減少・抑制される方向に影響を与えると考えられます。
このように、GαサブユニットのGTPase活性は信号強度の「タイミング制御」に重要であり、亢進した場合はシグナル伝達の減弱につながるとされます。
CatやCAMPのような二次メッセンジャーは、どのようにして細胞外シグナルを伝達し増幅できるのかを説明せよ。
二次メッセンジャーとは
Cat(カテコールアミン)やcAMP(サイクリックAMP)は、細胞外からのシグナル(ファーストメッセンジャー)が細胞表面受容体に結合すると、細胞内に生成される小分子またはイオンで、「細胞内シグナル伝達」を行います。特にcAMPは代表的な二次メッセンジャーの一つです。
二次メッセンジャーによるシグナル伝達と増幅の仕組み
- ファーストメッセンジャーの受容体結合
ホルモンや神経伝達物質などが細胞膜上の受容体(例:Gタンパク質共役受容体)に結合すると、細胞内の酵素(例:アデニル酸シクラーゼ)が活性化されます。 - 二次メッセンジャーの生成
活性化された酵素により、ATPからcAMPが大量に合成されたり、Ca2+が細胞内に放出されたりします。 - シグナルの伝達と増幅
- 多段階のシグナル伝達ネットワーク形成
二次メッセンジャーは複数のシグナル経路を連結し、多様で迅速な細胞応答を可能にします。
このように、二次メッセンジャーは細胞外の信号を受け取り細胞内へ効果的に伝達し、小分子の多量合成やイオン放出によって情報を増幅することで細胞の多様な応答を調節しています。
細菌のコレラ菌が産生するコレラ毒素は、感染した個体に水のような下痢の症状をひき起こす。コレラ毒素によるこの効果の分子機構は何か。
コレラ毒素はコレラ菌が産生するタンパク質毒素で、感染者に水様性下痢を引き起こします。その分子機構は以下の通りです。
- 細胞表面への結合
コレラ毒素のBサブユニットは腸管上皮細胞の表面にある糖脂質GM1に結合し、Aサブユニットを細胞内に導入します。 - GαsサブユニットのADPリボシル化
毒素のA1部分は細胞内でGαsタンパク質をADPリボシル化修飾し、そのGTPase活性を阻害します。これによりGαsはGTP結合型の活性状態から離れられなくなり、恒常的に活性化された状態になります。 - アデニル酸シクラーゼの持続的活性化
活性化されたGαsはアデニル酸シクラーゼ(AC)を持続的に刺激し、細胞内のcAMP濃度が異常に上昇します。 - cAMPによるイオン輸送異常と水分分泌
cAMPの増加により、腸管上皮細胞のイオンチャネル(特にCFTR)が活性化され、イオンの過剰分泌が起こります。その結果、水分も腸腔内に過剰に分泌され下痢が生じます。
このように、コレラ毒素は細胞のGタンパク質の機能を不正に持続化し、細胞内シグナルを異常に増幅させることで腸の水分バランスを崩し、激しい水様性下痢を引き起こすのです。
アドレナリンはアドレナリンβ受容体とアドレナリンα受容体の両方に結合する。アドレナリンがそれら2種類の受容体と結合したときに、エフェクタータンパク質であるアデニル酸シクラーゼに及ぼす効果はどう異なるのか。アドレナリンβ受容体にアゴニストあるいはアンタゴニストを作用させたときに、アデニル酸シクラーゼの活性はそれぞれどうなるか。
アドレナリンβ受容体とアドレナリンα受容体のアデニル酸シクラーゼへの効果の違い
- アドレナリンβ受容体は主にGsタンパク質(促進性Gタンパク質)と共役し、受容体からの刺激によりGαsが活性化されます。活性化されたGαsはアデニル酸シクラーゼ(AC)を刺激して活性化し、ATPからcAMPを生成します。これにより細胞内シグナル経路が活性化されて生理作用を発現します。
- アドレナリンα受容体のうち、α2受容体はGiタンパク質(抑制性Gタンパク質)と共役し、活性化されるとGαiがアデニル酸シクラーゼを抑制します。これによりcAMPの生成が抑制され、逆の調節効果が生じます。
アドレナリンβ受容体におけるアゴニスト・アンタゴニストの影響
- アゴニスト
β受容体にアゴニストが結合すると、受容体が活性化し、Gsタンパク質を介してアデニル酸シクラーゼを活性化します。これにより細胞内のcAMP量が増加します。 - アンタゴニスト
β受容体にアンタゴニストが結合すると、受容体の活性化が阻害され、Gsタンパク質が活性化されず、結果的にアデニル酸シクラーゼの活性も抑制されます。cAMPの生成は減少します。
このように、アドレナリンβ受容体はアデニル酸シクラーゼの刺激を通じてcAMPを増加させ、アゴニストは活性化、アンタゴニストは抑制の効果を持ちます。一方、アドレナリンα受容体の一部は逆にアデニル酸シクラーゼを抑制し、細胞応答に多様性をもたらします。
視覚におけるロドプシンと心筋におけるムスカリン性アセチルコリン受容体は、ともにGタンパク質を介してイオンチャネルと共役している。これらの二つの系の間での類似点と相違点を述べよ。
類似点
- Gタンパク質共役受容体(GPCR)であること
ロドプシンもムスカリン性アセチルコリン受容体も膜貫通型受容体であり、リガンド(光やアセチルコリン)によって活性化されると、細胞内のGタンパク質を活性化する。 - シグナルのGタンパク質伝達
両者ともに受容体が活性化すると、三量体Gタンパク質のαサブユニットまたはβγサブユニットが分離し、標的のイオンチャネルを調節することでシグナル伝達を行う。 - イオンチャネルの調節を介した細胞応答発現
活性化されたGタンパク質部分がイオンチャネルの開閉を制御し、細胞の膜電位変化やイオン流入・流出を起こして細胞応答を導く。
相違点
- 入力シグナルの種類の違い
- ロドプシンは光(光子)を検出する受容体であり、光刺激による構造変化がシグナル伝達のトリガーとなる。
- ムスカリン性アセチルコリン受容体は化学物質であるアセチルコリンを受け取り、化学シグナルを伝達する。
- イオンチャネルの種類や調節様式
- ロドプシンは視細胞の特異的なイオンチャネル(cGMP依存性チャネル)をGタンパク質(トランスデューシン)を介して閉じる方向に調節し、膜電位の過分極を引き起こす。
- ムスカリン性受容体はGタンパク質を介し、βγサブユニットが直接カリウムチャネルを開くなど、チャネルを開く方向に調節することが多い。
- Gタンパク質の種類の違い
- ロドプシンは主にトランスデューシン(Gt)という特異的なGタンパク質と結合。
- ムスカリン性受容体はGi/oやGqなどのGタンパク質と結合し、多様な下流経路を活性化する。
まとめ
ロドプシンとムスカリン性アセチルコリン受容体は、Gタンパク質を介したイオンチャネルの調節という基本的なシグナル伝達メカニズムを共有しながらも、入力シグナルの種類、利用するGタンパク質のタイプ、調節するイオンチャネルの種類と活性化様式が異なるため、それぞれが異なる生物学的機能を持っています。
Gs タンパク質共役型受容体がリガンドによる刺激を受け続けると、脱感作という現象が起こる。受容体を脱感作させるいくつかの分子機構について述べよ。受容体はどのようにしてもとの感作状態に戻るのか。突然変異によって、リン酸化されるセリンあるいはトレオニンが失われてしまった受容体をもつ細胞の性質はどうなるか。
脱感作を引き起こす主な分子機構
- Gタンパク質共役受容体キナーゼ(GRK)による受容体のリン酸化
リガンドが受容体に結合・活性化後、GRKが受容体の細胞内側のセリン・トレオニン残基をリン酸化します。 - β-アレスチンの結合
リン酸化された受容体はβ-アレスチンというタンパク質と結合します。これによりGタンパク質が受容体へ結合できなくなり、シグナル伝達の抑制が起こります。 - 受容体のエンドサイトーシス(細胞内取り込み)
β-アレスチンは受容体のクラスリン依存性エンドサイトーシスを促進し、受容体が細胞膜から取り除かれます。これにより受容体の細胞表面数が減少して感受性が低下します。 - Gタンパク質非依存的シグナル伝達への切り替え
β-アレスチン結合受容体は、Gタンパク質以外の経路(例:ERK1/2経路)を活性化することもあります。
受容体が元の感作状態に戻る仕組み
- 脱リン酸化酵素による受容体のリン酸化除去
受容体は脱感作後、細胞内で脱リン酸化されて感受性を回復します。 - 受容体のリサイクリング
エンドサイトーシスで取り込まれた受容体は、リサイクリングされて細胞膜に戻り、再び活性化可能な状態になります。
セリンまたはトレオニンのリン酸化部位が失われた受容体をもつ細胞の性質
- リン酸化部位が欠失していると、GRKによるリン酸化が阻害され、β-アレスチンの結合が減少・消失します。
- そのため、受容体が脱感作されず、過剰なシグナル伝達が継続する傾向があります。
- 結果として、細胞はリガンド刺激に対して過敏になり、恒常性が乱れる可能性があります。
このように、GPCRの脱感作は受容体のリン酸化・β-アレスチン結合・エンドサイトーシスなど複合的な制御メカニズムによって調節され、リン酸化部位の欠失は脱感作機構の破綻をもたらします。
視覚順応と受容体の脱感作には、同じようなリン酸化機構が存在する。これらの過程でアドレナリンβ受容体キナーゼ(BARK)とロドプシンキナーゼが果たす重要な役割について述べよ.これらの反応において脱リン酸の果たす役割は何か。
BARK(アドレナリンβ受容体キナーゼ)とロドプシンキナーゼの役割
- **BARK(β-アドレナリン受容体キナーゼ)**は、アドレナリンβ受容体の細胞内領域の特定のセリン・トレオニン残基をリン酸化する酵素です。これにより受容体が変化し、β-アレスチンの結合を促進して受容体の脱感作や内部化を引き起こします。
- ロドプシンキナーゼも同様に、光刺激で活性化されたロドプシンのC末端領域のセリン・トレオニンをリン酸化します。このリン酸化はロドプシンの活性を迅速に抑え、視細胞の感度調節(視覚順応)に重要な役割を果たします。
両者ともに特異的受容体に結合してその活性を調節し、過剰な刺激から細胞を守るシグナルのネガティブフィードバック機構の重要な要素です。
脱リン酸の役割
- リン酸化された受容体は、時間の経過とともに脱リン酸化酵素(ホスファターゼ)によりリン酸基を除去されます。
- これにより受容体の構造が元に戻り、β-アレスチンが解離し、受容体は再び活性状態に戻って細胞表面にリサイクリングされることが可能になります。
- 脱リン酸化は受容体の再感作や視覚感度の回復に不可欠な段階であり、シグナル伝達のリセットに寄与します。
このように、BARKとロドプシンキナーゼはそれぞれの受容体に対しリン酸化を行い、脱感作・順応の機構を動かします。そして脱リン酸化はそのプロセスを逆行させ、受容体機能の回復に重要な役割を果たしています。
しばしば細胞は、シグナル伝達経路の効果を特定の細胞内部位に局在化させることが必要である。その一つの例は、心筋におけるcAMP シグナルの局在化である。どのようなタンパク質が介在しているか。このシステムはどのように機能するか。
介在するタンパク質
- **AKAP(A-kinase anchoring proteins)**がcAMP依存性プロテインキナーゼ(PKA)を細胞内の特定の場所に固定化する役割を持つ。
- AKAPは、心筋細胞内でPKAやアデニル酸シクラーゼ、ホスホジエステラーゼ(PDE)、イオンチャネルなどのタンパク質と複合体を形成し、シグナルの局在化と効率的な伝達を実現する。
システムの機能
- 心筋細胞では、βアドレナリン受容体刺激によりアデニル酸シクラーゼが活性化され、cAMPが生成される。
- AKAP複合体はcAMPの作用点となるPKAをターゲットに局在化させるため、cAMP濃度が細胞内で局所的に制御され、必要な場所でのみシグナルが発現する。
- PDEも同様にAKAP複合体に含まれ、cAMPを分解することでシグナルの強度と持続時間が細胞内部で精密に調節される。
- これにより心筋の収縮機能などの生理的プロセスへ適切にシグナル伝達が行われ、過剰なシグナルを防ぐことが可能となる。
この局在化機構は、広い細胞内空間において効率的かつ特異的にシグナルを伝え、細胞応答の精緻な制御を可能にしています。
イノシトール 1,4,5ートリスリン酸(IP3)とジアシルグリセロール(DAG)という二つの二次メッセンジャーは、ホスファチジルイノシトール4,5ービスリン酸(PIP2)が活性化されたホスホリパーゼCによって切断されて生成する。小胞体からのCa2+放出におけるIP3の役割について述べよ。細胞はどのようにして小胞体のCa2+貯蔵量を維持するのか。DAGの主要な役割は何か。
IP3の役割
- IP3は小胞体膜上に存在する**IP3受容体(IP3R)**に結合することで、チャネルを開口させます。
- これにより小胞体内に蓄えられているCa2+が細胞質へ放出され、細胞内のCa2+濃度が局所的に上昇します。
- こうしたCa2+の動員は、筋収縮、分泌、代謝調節、シグナル増幅など多様な細胞応答のトリガーとなります。
小胞体のCa2+貯蔵量の維持
- 細胞はCa2+の濃度勾配を保つために**Sarco/Endoplasmic Reticulum Ca2+-ATPase(SERCA)**というCa2+ポンプを小胞体膜に持ちます。
- SERCAは細胞質からCa2+を小胞体内に能動輸送し、小胞体のCa2+貯蔵量を回復・維持して、IP3による放出後も再び貯蔵状態を保つことが可能とします。
DAGの主要な役割
- DAGは細胞膜に残留して、**プロテインキナーゼC(PKC)**を活性化します。
- PKCはリン酸化酵素として多くの基質タンパク質を修飾し、細胞の代謝や分泌、細胞増殖など多様な機能調節に関与します。
- また、DAGは一部のイオンチャネル(TRPCチャネルなど)を活性化する役割も持ちます。
このように、IP3は小胞体からのCa2+放出を直接媒介し、DAGはPKCなどの下流シグナルを活性化することで、PIP2分解後のシグナル伝達を円滑かつ効果的に進めています。細胞はSERCAによって小胞体内のCa2+を再蓄積し、シグナルの持続性と細胞の恒常性を維持しています。
最近の研究から、摂食行動と睡眠の間を関連づける驚くべき分子が同定された。両経路によって共有されているかもしれないシグナル伝達因子について述べよ。
摂食行動と睡眠を関連づけるシグナル伝達因子
- オレキシン(ヒポクレチン)
視床下部に存在する神経細胞から分泌される神経ペプチドで、もともとは覚醒や睡眠覚醒サイクルの制御に関与していることが知られていました。
近年の研究では、オレキシンは摂食行動やエネルギー代謝の調節にも重要な役割を果たすことが判明し、睡眠と摂食の両方の神経回路に関与する共通のシグナル因子として注目されています。 - オレキシン神経系は、摂食の促進と覚醒の維持を強力に促進するため、エネルギーホームオスタシスの保持における中心的な役割を担っています。
- オレキシンのシグナル伝達は、細胞内でGタンパク質共役型受容体を通じて行われ、神経活動の調節や複数の神経回路を活性化します。これによって、摂食の促進や覚醒維持、体内エネルギーバランスの調節を実現しています。
まとめ
オレキシンは、睡眠・覚醒の調節と摂食制御という一見異なる生理機能を分子レベルで結びつける重要なシグナル伝達因子であり、これが両経路の関連性を支えていると考えられています
問題文引用元:東京化学同人 分子細胞生物学 第6版

コメント