- ”Palade とその共同研究者は放射能標識したアミノ酸でパルスーチェイスし,その行方をオートラジオグラフィーで調べ、膵臓の膵房細胞で新たに合成されたタンパク質の局在を明らかにした。これら初期の研究から、タンパク質の合成と膜に包まれての輸送という重要な情報が得られた。新しい手法も開発されているが、この種のタンパク質輸送の研究に使うためには二つの基本的要件をみたす必要がある。その二つの要件とは何か。それにかなった実験法を手短に紹介せよ。 ”
- 酵母のsec18遺伝子はNSFをコードしている。その突然変異は分泌経路にC型表現型の異常を起こさせる。膜輸送機構におけるNSFの役割は何か。C型表現型とよばれるようにNSFの突然変異が分泌経路のある段階に小胞を蓄積させるが、それはなぜか。
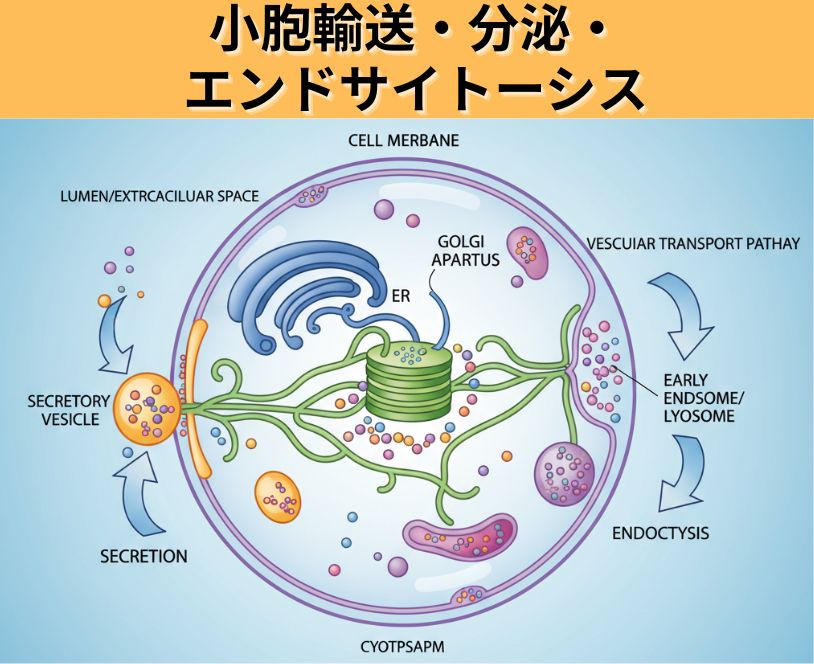
- 小胞出には被覆タンパク質が関与する。小胞出における被タンパク質の役割は何か。どのように被覆タンパク質は腹に集まってくるのか。新しくつくられた小胞にはどのような分子が取込まれ、どのような分子が排除されるのか。小胞の切り離しに関与していると考えられているタンパク質の例として最もよく知られているものは何か。
- 細胞をブレフェルジン A (BFA)という試薬で処理するとゴルジ体膜の被覆が失われ、ゴルジ体タンパク質の大半は小胞体にとどまる。この観察結果から。被覆タンパク質は小胞形成を促すこと以外にどのような役割を果たしていると考えられるか。Arf1にどのような突然変異が起こればBFAで処理したのと同じ効果を細胞に与えることができるか予想せよ。
- EAGEとよばれるCOPIβの露出した“接ぎ手部分に対する抗体をHela細胞に微量注入するとCOPIβの機能が阻害される。小胞体から細胞膜への順行性輸送においてこの阻害はどのような結果をもたらすか予想せよ。EAGE微量注入の初期効果が順行性輸送に出るのか逆行性輸送に出るのかを調べるにはどのような実験を行ったらよいか述べよ。
- 小胞どうしが特異的に融合するとき二つの異なった過程が連続して起こる。そのうちの最初の過程とそのGTPase スイッチタンパク質による調節について述べよ、GTP結合型のまま止まってしまう Rab5 の変異タンパク質を過剰発現させたとき、初期エンドソームの大きさにどのような影響がでるか。
- 分泌経路におけるタンパク質の逆行性輸送を起こさせる選別シグナルは回収配列ともよばれる。小胞体の水溶性タンパク質と膜タンパク質のもつ回収配列の例を二つあげよ。小胞体水溶性タンパク質がシスゴルジから回収される際にこの回収配列はどのように働くのか。嚢成熟モデルにとってこの回収配列というものがどれだけ必須であるかについて述べよ。
- クラスリンのアダプタータンパク質(AP)複合体はクラスリンだけでなく膜タンパク質の細胞質側部分とも結合する。現在知られている 4種類のアダプタータンパク質複合体とはどのようなものか.クラスリンがアダプタータンパク質からなる被覆実質部分に結合する付帯物とみなされかねないのはなぜか。
- ヒトのⅠ細胞病は水溶性リソソームタンパク質を含むあらゆる種類のタンパク質の輸送に影響を及ぼす遺伝病である。Ⅰ細胞病をひき起こす分子レベルでの欠陥とは何か。なぜそれはあらゆる種類のタンパク質の輸送に影響を与えるのか。同様な表現型をもたらす突然変異としてはどのようなものがあるか。
- トランスゴルジ網(TGN)はゴルジ体から出てきたタンパク質や脂質がさまざまな選別を受ける場所である。リソソームへの選別と調節された分泌小胞(たとえばインスリンを含む小胞)への選別とを対比させながら比較せよ。側底膜と頂端膜へのタンパク質の選別のされ方がMDCK細胞と肝細胞でどう異なるかを対比させながら比較せよ。
- マンノース6-リン酸とその受容体との相互作用の調節にpHがどれだけ重要な役割を果たしているかを述べよ。エンドソーム内のpHを上げると新たに合成されてきたリソソーム酵素が細胞外に分泌されてしまうのはなぜか。
- エンドソーム膜が内側に出芽することによってつくられる多胞エンドソーム形成(a)と細胞表面でのHIVの外側への出芽(b)の機序における共通点は何か。HIV出芽を阻害/拮抗するペプチドをつくろうと計画し、HIV Gagタンパク質の一部分と類似したペプチドを合成することにした。論理的にみて HIV Gag タンパク質のどの部分に類似したものにすべきか。この阻害ペプチドは正常な細胞内過程のうちのどこを阻害する可能性があるか。
- ファゴサイトーシス経路とオートファジー経路は二つの重要な役割を果たしている経路だが、どちらも内容物をリンソームに送り込んでいる。両経路の基本的な違いは何か。オートファゴソームの形成と融合における三つの段階を説明せよ。
”Palade とその共同研究者は放射能標識したアミノ酸でパルスーチェイスし,その行方をオートラジオグラフィーで調べ、膵臓の膵房細胞で新たに合成されたタンパク質の局在を明らかにした。これら初期の研究から、タンパク質の合成と膜に包まれての輸送という重要な情報が得られた。新しい手法も開発されているが、この種のタンパク質輸送の研究に使うためには二つの基本的要件をみたす必要がある。その二つの要件とは何か。それにかなった実験法を手短に紹介せよ。 ”
必要な二つの基本要件
- 「新しく合成された」分子だけを時間的に区別して追跡できること
- 既存タンパク質ではなく、その時点から合成された分子だけをラベルして、時間経過に伴う位置変化を追える必要がある。
- 細胞内の「どこに存在するか」を空間的に分解して可視化できること
- 小胞体、ゴルジ体、分泌小胞、細胞外など、コンパートメントごとの局在を分解・同定できる必要がある。
Palade のパルスチェイス+オートラジオグラフィーは、この2つ(時間的ラベリング+細胞内局在の可視化)を満たした古典的手法の代表といえる。
それにかなう実験法の例
1. パルスチェイス標識+オートラジオグラフィー(古典的手法)
- 一定時間だけ放射性アミノ酸(³⁵S-メチオニンなど)で「パルス」ラベル → 以後は非標識アミノ酸で「チェイス」。
- 一定時間ごとに細胞を固定し、オートラジオグラフィーで銀粒子の位置(放射能の位置)を電顕・光顕で観察する。
- 時間軸に沿って、小胞体 → ゴルジ体 → 分泌小胞 → 細胞外へと移動する標識タンパク質の軌跡を追跡できる。
→「新規合成分子のみを時間窓で標識」し、「細胞内のどの膜区画にいるかを顕微鏡で可視化する」という二要件を満たす。
2. 蛍光標識タンパク質+ライブセルイメージング
- タンパク質を GFP などの蛍光タンパク質と融合させ、細胞内で発現させる。
- フォトコンバージョン型蛍光タンパク質(Kaede, Dendra など)やパルスラベリング可能なタグ(HaloTag, SNAP-tag)を使うと、「ある時点以降に合成された分子だけ」を色変換などで選択的に追跡できる。
- 共焦点顕微鏡やスピニングディスク顕微鏡で、小胞体→ゴルジ→小胞→膜などへのリアルタイム輸送を可視化できる。
→パルスチェイスに相当する「時間分解」と、蛍光顕微鏡による「空間分解」を同時に満たす。
3. サブセルフラクショネーション+免疫検出
- パルスラベル後、短時間ごとに細胞を破砕し、遠心分離で小胞体画分、ゴルジ画分、分泌顆粒画分などに分ける。
- 各画分で放射能量測定や、特異抗体による免疫ブロットを行い、どの時間にどの画分へ新生タンパク質が移ったかを量的に追跡する。
→顕微鏡ではなく「生化学的分画+定量」で、時間軸とコンパートメントの両方を満たす手法。
要するに、この種の輸送研究に必要なのは
「(1) 新規合成タンパク質を時間的に選択的にラベルできること」
「(2) その位置を細胞内コンパートメントごとに分解して同定できること」
であり、パルスチェイス+オートラジオグラフィー、蛍光融合タンパク質のライブイメージング、分画+免疫検出などがその要件にかなう代表的アプローチとなる。
酵母のsec18遺伝子はNSFをコードしている。その突然変異は分泌経路にC型表現型の異常を起こさせる。膜輸送機構におけるNSFの役割は何か。C型表現型とよばれるようにNSFの突然変異が分泌経路のある段階に小胞を蓄積させるが、それはなぜか。
NSF(Sec18p)の役割
NSF(酵母ではSec18p)は、AAA+ファミリーに属するATPアーゼで、SNARE複合体の解離(リサイクル)を担う因子である。
小胞と標的膜が融合したあと、v-SNAREとt-SNAREが「cis-SNARE複合体」として同じ膜上に絡み合った状態になるが、NSFはSNAP(Sec17p)とともにこのcis-SNARE複合体に結合し、ATP加水分解のエネルギーでSNARE複合体をばらし、個々のSNAREを次の輸送サイクルに再利用可能な状態に戻す。
その結果:
- SNARE分子が再びv-SNARE(小胞側)、t-SNARE(標的膜側)として配置され、
- 次の小胞ドッキング・膜融合イベントが進行できるようになる。
つまりNSFは、「膜融合そのもののトリガー」というより融合後のSNAREの再生装置=小胞輸送サイクルのリセット役であり、これがなければ膜輸送は途中で詰まる。
C型表現型で小胞が蓄積する理由
sec変異は、分泌経路のどの段階で小胞が詰まるかによって A, B, C 型などに分類されるが、C型表現型は、ゴルジや形質膜など特定区画の前段階で輸送小胞が大量に蓄積するタイプである。
NSF(Sec18p)に変異があると:
- 一度融合に使われたSNARE複合体が解離できず、「使い捨て」状態になる。
- SNAREが再利用されないため、標的膜側に機能的なt-SNAREセットが不足し、新たな輸送小胞がドッキング/融合できなくなる。
- しかし、小胞形成(出芽)自体は比較的保たれているので、出芽した小胞だけが次々と蓄積し、輸送の“交通渋滞”が起こる。
その結果として:
- 小胞体→ゴルジ、ゴルジ→形質膜など、NSF依存の段階で小胞が山積みとなり、顕微鏡や密度勾配遠心で「小胞の蓄積」として観察される。
- この「形成はするが融合できずに溜まる」という性質が C 型表現型とよばれる所以であり、その分子原因が「SNARE複合体のリサイクル不全=NSF/Sec18pの機能欠損」にある。
まとめると:
- NSF(Sec18p)は、SNARE複合体をATP依存的に解離し、SNAREを次の輸送サイクルに再利用させるATPアーゼである。
- sec18(NSF)の突然変異ではSNARE再生ができないため、標的膜での新たな融合が止まり、小胞が特定段階で蓄積する「C型表現型」の分泌異常が生じる。
小胞出には被覆タンパク質が関与する。小胞出における被タンパク質の役割は何か。どのように被覆タンパク質は腹に集まってくるのか。新しくつくられた小胞にはどのような分子が取込まれ、どのような分子が排除されるのか。小胞の切り離しに関与していると考えられているタンパク質の例として最もよく知られているものは何か。
被覆タンパク質の役割
- 被覆タンパク質(クラスリン、COPI、COPIIなど)は、ドナー膜の特定領域に集合して**「膜を曲げて芽(bud)を形成する骨組み」**として働く。
- 同時に、アダプタータンパク質(AP複合体やSec23/24など)と協調して、**輸送すべき「積み荷(cargo)」分子を選択的に結合・濃縮する「選別装置」**の役割も果たす。
被覆タンパク質はどう集まるか
- ドナー膜上には、輸送先や経路ごとに**シグナルをもつ膜タンパク質(sorting signals)**が存在し、アダプタータンパク質がそのシグナルや特定リン脂質(例:PIP₂)に結合する。
- これらアダプター(AP-1/AP-2、Sec23/24、COPI coatomerなど)が集まると、それに結合する外側コート(クラスリン三脚、COPI, COPIIサブユニット)が次々と重合し、局所的に“コート格子”ができて膜が丸く持ち上がる。
- ERやゴルジ由来のCOPII/COPI小胞では、Sar1やArf1などの小型GTPaseがGTP結合型になることで膜に挿入され、コートの核としてアダプターのリクルートを開始する。
小胞に取り込まれる・排除される分子
- 取り込まれるもの(cargo)
- 排除されるもの
小胞の切り離しに関与する代表的タンパク質
このように、被覆タンパク質は「膜変形+貨物選別」の二重の役割を担い、GTPaseやダイナミンなどと協調して、小胞の形成から切り離しまでを精密に制御している。
細胞をブレフェルジン A (BFA)という試薬で処理するとゴルジ体膜の被覆が失われ、ゴルジ体タンパク質の大半は小胞体にとどまる。この観察結果から。被覆タンパク質は小胞形成を促すこと以外にどのような役割を果たしていると考えられるか。Arf1にどのような突然変異が起こればBFAで処理したのと同じ効果を細胞に与えることができるか予想せよ。
被覆タンパク質が果たすもう一つの役割
BFA処理によりCOPIコートのリクルートが阻害されると、ゴルジ体から小胞体への逆行輸送が止まり、ゴルジ酵素などがER側にとどまる/再分配されることが知られている。
このことから、被覆タンパク質(特にCOPIコート)は
- 単に「小胞の芽を出す・形をつくる」だけでなく、
- 特定のタンパク質(ゴルジ酵素やリサイクルシグナルを持つ膜タンパク質)を選択的に認識・回収し、適切な区画(ERや近位ゴルジ)へ戻す“選別・リサイクリング因子”としての役割も担っていると考えられる。
つまり、COPIなどの被覆タンパク質は
- 順行輸送だけでなく逆行輸送によるコンパートメント恒常性維持(ゴルジ酵素の再循環、ER逃避タンパク質の回収)に必須であり、
- BFAでコートのリクルートが止まると、この再循環が破綻し、ゴルジタンパク質がERに偏在する。
Arf1にどんな変異があればBFAと同じ効果か
BFAは、Arf1自身ではなく**Arf1を活性化するGEF(Sec7ドメインを持つGBF1/BIGファミリーなど)**に結合してその機能を阻害し、Arf1をGTP型にできなくする(=Arf1が膜に安定結合できずCOPIを呼べない)。
したがって、BFAを使わずに同様の状態を作るArf1変異としては:
- GDP結合型に固定される変異(機能喪失型)
逆に、GTP結合型に固定された「コンスティテュティブ活性型 Arf1(Q71L など)」では、コートの過剰結合やゴルジの肥大化が起き、BFAとは逆のフェノタイプになることが知られている。
従って、**BFAと同じ効果をもたらすのは「Arf1がGTP型になれず、COPIを膜に呼び込めないGDP型固定(不活性型)変異」**であると予想できる。
EAGEとよばれるCOPIβの露出した“接ぎ手部分に対する抗体をHela細胞に微量注入するとCOPIβの機能が阻害される。小胞体から細胞膜への順行性輸送においてこの阻害はどのような結果をもたらすか予想せよ。EAGE微量注入の初期効果が順行性輸送に出るのか逆行性輸送に出るのかを調べるにはどのような実験を行ったらよいか述べよ。
1. COPIβ(EAGE)阻害が順行性輸送に与える影響
COPIコートは主に「ゴルジ体→ERへの逆行性輸送」やゴルジ内のリサイクリングに関わるが、これが阻害されると順行輸送にも間接的な影響が出る。
- 予想される結果
つまり、COPIβのEAGE領域に対する抗体は、直接は逆行性輸送を止めるが、その結果としてゴルジ機能崩壊を通じて順行性輸送も障害される。
2. 初期効果が順行性か逆行性かを見分ける実験
「最初に」異常が出るのが
- ER→ゴルジ→細胞膜の順行性なのか
- ゴルジ→ERの逆行性なのか
を切り分けるには、順行マーカーと逆行マーカーを時間分解で同時観察する実験を行う。
実験の例
- 順行性輸送の指標
- 逆行性輸送の指標
- 時間経過の比較
このように、COPIβ(EAGE)抗体による阻害は、まずCOPI依存の逆行性輸送・ゴルジ維持に影響を与え、その二次的結果として順行性輸送の破綻につながると考えられる。
小胞どうしが特異的に融合するとき二つの異なった過程が連続して起こる。そのうちの最初の過程とそのGTPase スイッチタンパク質による調節について述べよ、GTP結合型のまま止まってしまう Rab5 の変異タンパク質を過剰発現させたとき、初期エンドソームの大きさにどのような影響がでるか。
1. 最初の過程とRab型GTPaseによる調節
小胞どうしの特異的融合は大きく
- テザーリング/ドッキング(tethering/docking)
- SNARE依存的膜融合
の二段階で進む。このうち「最初の過程」は、RabファミリーGTPaseによって制御されるテザーリング/ドッキング段階である。
- Rab GTPaseは、GDP結合型(不活性)とGTP結合型(活性)を行き来する分子スイッチ。
- 活性型Rab(Rab5-GTPなど)が標的膜・小胞膜に結合し、
- その後にSNARE同士が正しく組み合わされて実際の膜融合が起こるが、Rabはこの“前準備”段階の空間特異性を担っている。
2. Rab5-GTP固定変異の過剰発現と初期エンドソームの大きさ
Rab5は初期エンドソームの形成・ホモタイピング融合(endosome–endosome fusion)を促進する主要GTPaseである。
GTP加水分解できないRab5変異(Q79Lなど、GTP結合型に固定)を過剰発現すると:
- Rab5が常に活性状態 → Rab5エフェクター(EEA1など)を持続的にリクルート。
- 初期エンドソーム間のホモタイピング融合が過剰に促進される。
- その結果、多数の小さな初期エンドソームが互いに融合して、「異常に大きく膨れた初期エンドソーム」が形成されることが示されている。
したがって、GTP結合型のまま止まるRab5変異タンパク質を過剰発現させると、
初期エンドソームは巨大化し、数は減るが1個あたりのサイズは著しく増大する、という形態変化が予想される。
分泌経路におけるタンパク質の逆行性輸送を起こさせる選別シグナルは回収配列ともよばれる。小胞体の水溶性タンパク質と膜タンパク質のもつ回収配列の例を二つあげよ。小胞体水溶性タンパク質がシスゴルジから回収される際にこの回収配列はどのように働くのか。嚢成熟モデルにとってこの回収配列というものがどれだけ必須であるかについて述べよ。
回収配列(例を二つ)
- 小胞体水溶性タンパク質の回収配列
- 小胞体膜タンパク質の回収配列
小胞体水溶性タンパク質の回収機構(KDEL/HDEL)
- ERルーメンタンパク質(BiP 等)が誤ってERからCOPII小胞に乗ってシスゴルジへ流出する。
- シスゴルジ膜に局在する**KDEL受容体(KDELR/Erd2p)**が、ルーメン側でKDEL配列を認識し結合する(低pH側で親和性高い)。
- KDELRの細胞質側尾部にはCOPI結合モチーフがあり、COPIコートをリクルートしてゴルジ→ER逆行小胞へ積み込まれる。
- ERに戻ると、pHの違いなどによりKDELタンパク質が受容体から解離し、ERルーメンに再放出される。受容体は再びCOPII小胞でゴルジへ戻り、サイクルを繰り返す。
このようにKDEL配列は、「逃げ出したERルーメンタンパク質をシスゴルジで捕獲し、COPI小胞に積み直してERへ“回収”するシグナル」として機能する。
嚢成熟モデルと回収配列の必須性
嚢成熟(cisternal maturation)モデルでは:
- 新しいシス槽が ER 由来小胞の融合で生じ、時間とともにシス→メディアル→トランスへ成熟すると考える。
- しかしその間も、各槽に本来局在すべき酵素セット(ゴルジ酵素、ERタンパク、受容体など)の“位置”を保つ必要がある。
このとき中心的役割を担うのがCOPI依存の逆行性輸送+回収配列である。
- ゴルジ酵素やKDELタンパク質、KKXXを持つER膜タンパク質は、次の槽へ「押し流される」一方で、
- 回収シグナル(KDEL、KKXX等)に基づいてCOPI小胞で元の区画やERへ戻される。
- これがないと、酵素セットが拡散してしまい、槽ごとの酵素組成勾配(cis~transの機能分化)が維持できない。嚢成熟モデルでは、この選択的逆行輸送=回収配列の機能が、モデル成立の前提条件に近い重要要素と位置付けられている。
したがって:
- 回収配列は、単に「逃げたERタンパク質を戻す」だけでなく、
- ゴルジ槽の成熟に伴う酵素分布の再配分と、ER・ゴルジのコンパートメント恒常性維持にとってほぼ必須のシステムであると考えられる。
クラスリンのアダプタータンパク質(AP)複合体はクラスリンだけでなく膜タンパク質の細胞質側部分とも結合する。現在知られている 4種類のアダプタータンパク質複合体とはどのようなものか.クラスリンがアダプタータンパク質からなる被覆実質部分に結合する付帯物とみなされかねないのはなぜか。
クラスリンアダプタータンパク質複合体とは
クラスリンのAP複合体は、ヘテロ四量体からなる「カーゴ選別+クラスリンリクルート」の中核ユニットで、現時点で以下の 4 種がよく知られている。
- AP-1
- 局在:トランスゴルジ網(TGN)とエンドソーム。
- 役割:TGN↔エンドソーム間輸送、小胞体酵素やリソソーム酵素受容体のソーティング。
- AP-2
- AP-3
- AP-4
(※現在はAP-5 も知られるが、クラスリンとは直接結びつかない非典型APとして扱われることが多い。)
なぜ「クラスリンが付帯物に見える」のか
クラスリンは格子状の被覆(トライスケリオン)をつくる**外側の「骨組み」**だが、カーゴ選別や膜への結合を実際に担っている主役はAP複合体側であるため、「アダプター実質に付着した付帯物」とさえ見なされ得る。
- AP複合体がやっていること
- クラスリン側の役割の相対化
このため、クラスリンは「アダプタータンパク質からなる被覆“実質”に後から結合する外側の補強材=付帯物」とみなされかねない、という表現が用いられる。
ヒトのⅠ細胞病は水溶性リソソームタンパク質を含むあらゆる種類のタンパク質の輸送に影響を及ぼす遺伝病である。Ⅰ細胞病をひき起こす分子レベルでの欠陥とは何か。なぜそれはあらゆる種類のタンパク質の輸送に影響を与えるのか。同様な表現型をもたらす突然変異としてはどのようなものがあるか。
分子レベルでの欠陥は何か
I 細胞病(mucolipidosis II)は、ゴルジ体で働くGlcNAc-1-ホスホトランスフェラーゼ活性の欠損(または重度低下)によって起こる。
この酵素はリソソーム酵素の糖鎖上にマンノース-6-リン酸(M6P)タグを付加する役割を持つが、欠損により新生リソソーム水解酵素にM6Pがほとんど付かない。
その結果:
- M6Pタグを認識するマンノース-6-リン酸受容体(MPR)がリソソーム酵素を捕まえられない
- その多くがリソソームへ届かず、分泌経路に乗って細胞外へ分泌されてしまう
- 一方、リソソーム内部は酵素欠乏となり、種々基質が分解されず封入体(inclusion)として蓄積する
この「M6Pタグ付加の欠陥」が I 細胞病の本質的分子異常である。
なぜ「あらゆる種類のタンパク質の輸送」に影響するのか
教科書的には「水溶性リソソーム酵素の輸送異常」が中心だが、以下の理由で輸送系全体に波及的影響が出る。
- M6Pタグが付かないため、ほぼすべてのM6P依存型リソソーム酵素が誤って分泌される。
- リソソームが機能不全になり、オートファジー・エンドサイトーシス由来の基質が分解されずに蓄積 → 種々のコンパートメントのpHや膜組成も異常化。
- エンドソーム‐リソソーム系の異常は、
したがって、「特定のリソソーム酵素だけ」でなく、「分泌系・エンドソーム系に関わる多数のタンパク質の輸送」が二次的に障害される。
同様の表現型をもたらす変異の例
I 細胞病と「よく似た(リソソーム酵素ミスソーティング)表現型」を引き起こすのは、M6P経路の他の要素に対する変異である。
- マンノース-6-リン酸受容体(MPR)の欠損・機能低下
- LYSET(TMEM251)など、M6Pタグ付加機構の周辺因子の欠損
- その他のリソソームへのソーティング因子の異常
まとめ
- I 細胞病の分子欠陥は「リソソーム酵素にM6Pタグを付ける Golgi の GlcNAc-1-ホスホトランスフェラーゼの欠損」であり、
- それが M6P 経路に依存する多くのリソソーム酵素の誤標的化を通じて、分泌・エンドソーム系全体に影響する。
- 同様な表現型は、M6P受容体やLYSET など、M6Pタグ付加・認識システムの他の構成因子の変異によっても引き起こされる。
トランスゴルジ網(TGN)はゴルジ体から出てきたタンパク質や脂質がさまざまな選別を受ける場所である。リソソームへの選別と調節された分泌小胞(たとえばインスリンを含む小胞)への選別とを対比させながら比較せよ。側底膜と頂端膜へのタンパク質の選別のされ方がMDCK細胞と肝細胞でどう異なるかを対比させながら比較せよ。
TGNでの選別:リソソーム vs 調節分泌小胞
リソソームへの選別
- シグナルと受容体
- 被覆と行き先
調節分泌小胞(例:インスリン)の選別
- シグナル様式
- 小胞形成と運命
→ リソソーム行きは「M6P–MPR–AP–クラスリン」による受容体介在型選別、調節分泌はcargo自身の凝集性とTGN内環境に依存したドメイン分離+専用顆粒形成という点で対照的。
頂端/側底膜への選別:MDCK vs 肝細胞
MDCK細胞(典型的極性上皮)
- 基本構造
- 頂端膜(apical):管腔側。
- 側底膜(basolateral):基底膜側+隣接細胞側。
- 側底膜ターゲティング
- 頂端膜ターゲティング
- 経路
肝細胞(胆管管腔をもつ特殊上皮)
- 極性が「反転」気味
- 肝細胞の「頂端膜」は隣接細胞間の胆毛細管(bile canaliculus)側で、狭い管腔に向く。
- 広い血液側が「側底膜」に相当。
- ソーティング様式の特徴
- シグナル利用の違い
まとめ(対比ポイント)
このように、TGNは共通の「ハブ」だが、行き先ごとにシグナル・受容体・キャリアの組み合わせが異なり、上皮のタイプ(MDCK vs 肝細胞)によって極性輸送の主ステップも変化する。
マンノース6-リン酸とその受容体との相互作用の調節にpHがどれだけ重要な役割を果たしているかを述べよ。エンドソーム内のpHを上げると新たに合成されてきたリソソーム酵素が細胞外に分泌されてしまうのはなぜか。
マンノース6-リン酸受容体とpHの役割
マンノース6-リン酸(M6P)とマンノース6-リン酸受容体(MPR)の結合は強くpH依存的で、これがリソソーム酵素の正しい仕分けに不可欠になっている。
- TGN(トランスゴルジ網)側:やや中性寄り(pH 6.3–6.7)
- エンドソーム側:より酸性(pH ≲5.5–6.0)
要するに、
- 「TGNのやや中性pHで結合」
- 「エンドソームの酸性pHで解離」
という**pH勾配が、MPRに結合した酵素をTGNからエンドソーム/リソソームへ“一方通行で輸送する分子スイッチ”**として働いている。
エンドソームのpHを上げると酵素が細胞外に分泌される理由
エンドソーム内のpHを上昇させる(酸性化を阻害する、つまりpHを中性側へ傾ける)と、上記のスイッチ機構が破綻する。
- MPR–酵素複合体がエンドソーム内で解離できなくなる
- MPRはTGNだけでなく形質膜にもサイクリングする
- 結果として「新生リソソーム酵素の細胞外分泌」が起きる
このように、M6P–MPR系では「TGNでの結合」と「酸性エンドソームでの解離」を切り替えるpH依存性が、リソソーム酵素を正しい行き先へ送り込むために極めて重要であり、エンドソームの酸性化阻害はそのスイッチを壊すことで酵素の細胞外分泌を引き起こす。
エンドソーム膜が内側に出芽することによってつくられる多胞エンドソーム形成(a)と細胞表面でのHIVの外側への出芽(b)の機序における共通点は何か。HIV出芽を阻害/拮抗するペプチドをつくろうと計画し、HIV Gagタンパク質の一部分と類似したペプチドを合成することにした。論理的にみて HIV Gag タンパク質のどの部分に類似したものにすべきか。この阻害ペプチドは正常な細胞内過程のうちのどこを阻害する可能性があるか。
多胞エンドソーム形成とHIV出芽の共通機序
共通点:ESCRT複合体の活用
(a) 多胞エンドソーム(MVB)形成と(b) HIVの細胞外側出芽は、内向き/外向きの膜ネック形成と切断(scission)という拓扑学的類似性を持ち、どちらもESCRT(Endosomal Sorting Complex Required for Transport)経路を介して実現する。
- 共通の分子機構
MVBではエンドソーム内腔へ小胞が内芽出し、HIVでは細胞外側へウイルス粒子が外芽出しするが、**ESCRTによる「膜ネックのESP(ESCRT-driven scission pathway)」**が共通の最終実行機構である。
HIV Gag阻害ペプチドの設計:どの部分を模倣するか
HIV出芽阻害のため、Gag p6領域のLate domain(L domain)モチーフに類似したペプチドを合成すべき。
論理的根拠と候補配列
- L domain-1:PTAP(P7TAP11)
- L domain-2:YPXnL(L35YPLRSL41など)
推奨:**PTAPモチーフ中心のペプチド(例:Ac-PSAAP-NH₂ または類似配列)**を合成。
- Tsg101結合部位を競合的に占有し、ESCRT-Iリクルートをブロック → 出芽ネック切断不能。
阻害ペプチドの正常細胞過程への影響
このPTAP模倣ペプチッドは、HIV特異的ではなく、正常細胞のESCRT依存過程すべてを阻害する可能性が高い。
影響を受ける主な細胞過程
- 多胞エンドソーム(MVB)形成:受容体ダウンレギュレーション、成長因子シグナル終結障害 → 腫瘍化促進。
- オートファジー:オートファゴソームのMVB様融合阻害 → タンパク質蓄積。
- 細胞分裂(cytokinesis):中期板のESCRT-III依存切断阻害 → 多核化。
- 核膜再構築:ESCRT-IIIによる膜切断阻害。
VP-16やdominant-negative VPS4と同様の広範な膜切断阻害表現型(MVB蓄積、分裂異常)が予想されるため、治療薬としての特異性確保にはHIV特異的修飾(例:Gag NC領域との融合)が必要。
ファゴサイトーシス経路とオートファジー経路は二つの重要な役割を果たしている経路だが、どちらも内容物をリンソームに送り込んでいる。両経路の基本的な違いは何か。オートファゴソームの形成と融合における三つの段階を説明せよ。
ファゴサイトーシスとオートファジーはどちらもリソソーム分解を介するが、内容物と誘導機構が根本的に異なる。
両経路の基本的な違い
- ファゴサイトーシス
- 内容物:細胞外の大型固形物(細菌、死細胞、粒子など)を貪食細胞(マクロファージなど)が取り込む。
- 膜起源:形質膜が内凹して一重膜のファゴソームを形成。
- 誘導:パターン認識受容体(TLRなど)やオプソニン(抗体・補体)による特異的認識。
- オートファジー
- 内容物:細胞質内の自成分(タンパク質凝集体、損傷オルガネラなど)を非選択的/選択的に分解。
- 膜起源:de novo形成の二重膜構造(ファゴフォア)からオートファゴソーム。
- 誘導:栄養欠乏(mTOR抑制)、ストレス(ERストレスなど)による内在的シグナル。
要するに、**ファゴサイトーシスは「外来異物防御」、オートファジーは「細胞内恒常性維持」**という機能的分化がある。
オートファゴソーム形成・融合の三段階
オートファジーは以下の三つの連続段階で進行する。
1. 核形成(phagophore nucleation)
- ファゴフォア(隔離膜、二重膜の杯状構造)がER出口部位(または他の膜源)でde novo形成開始。
- Atg1/ULK複合体(mTOR抑制で活性化)がPI3K複合体III(Vps34/Atg14)をリクルートし、PI3Pを生成。
- PI3PがAtg18/WIPI、Atg9を呼び寄せ、ファゴフォアの骨格を構築。
2. 伸長・閉鎖(elongation and closure)
- ファゴフォアが細胞質成分を包み込み、球状のオートファゴソームに閉鎖。
- 二つのユビキチン化様連鎖:
- Atg12–Atg5–Atg16L1複合体(E1/E2/E3様)が外側膜に結合。
- LC3/Atg8がPE(ホスファチジルエタノールアミン)に脂質化されて内・外膜に固定。
- LC3-PEが膜伸長を駆動し、内容物を隔離。
3. リソソーム融合(docking and fusion)
- オートファゴソームがリソソームと融合し、オートリソソームを形成。
- **Rab7、SNARE(STX17, SNAP29, VAMP8)**がテザリング・融合を媒介。
- LAMP2やESCRTが膜融合を補助し、内内容物がリソソーム酵素で分解(autolysosome)。
この三段階により、オートファジーは細胞質を効率的にリソソームへ送り、栄養再利用や品質管理を実現する。
問題文引用元:東京化学同人 分子細胞生物学 第6版


コメント