- 接着分子の多様性を生じる二つの現象を、特定の例を用いて説明せよ。
- カドへリンは細胞間での同種間相互作用をすることが知られている。同種間相互作用とは何か。また、それをEカドヘリンを用いた実験でどのように示すことができるか。
- 接着結合は、隣接した上皮細胞の側方面をつなぐ役割に加えて、細胞の形を制している。この役割に関与するタンパク質は何で、どのような構造をもつか。
- 密着結合の正常な機能は何か。密着結合が適切に働かないと、組織にどのようなことが起こりうるか。
- コラーゲンとは何か、そしてこれはどのように合成されるか。コラーゲンが組織のまとまりに必要であることは何からわかるか。
- 構造モデルを用いて,インテグリンがどのように外から内へ、また内から外へのシグナル伝達を仲介しているかを説明せよ。
- すべての組織の細胞外マトリックスに多量に存在する3種類の巨大分子それぞれの機能と性質を比較せよ。
- 多くのプロテオグリカンには細胞のシグナル伝達の役割がある。その一例に、脳の視床下部におけるシンデカンによる摂餌行動の調節がある。この調節はどのように行われるか。
- 両側に別のアミノ酸を含むRGD配列をもつオリゴペプチドを合成した。培養皿にフィブロネクチンの層を吸着させてその上で育てた培養繊維芽細胞に,このペプチドを加えたときにどのような影響が現れるか。またその理由を説明せよ。
- 血液凝固は、哺乳類の生存のために必須な機能である。フィブロネクチンの多価接着能は、どのように血小板を凝固塊に集めるのか。
- 細胞外マトリックスと細胞骨格の分子的な連結が変化すると、どのようにデュシェンヌ型筋ジストロフィーがひき起こされるのか。
- 白血球は、感染防衛のために血液中から感染部へと速やかに移動する。この過程は何とよばれているか。また、この過程に接着分子はどのようにかかわっているか。
- 植物の細胞壁の構造は、細胞を成長させるために緩む必要がある。この過程を制御するシグナル伝達分子は何か。
- 植物細胞の原形質連絡と動物細胞のギャップ結合を比較せよ。
接着分子の多様性を生じる二つの現象を、特定の例を用いて説明せよ。
接着分子の多様性を生じる二つの主要な現象は、オルタナティブ・スプライシングと糖鎖修飾の多様性である。
1. オルタナティブ・スプライシング(代替スプライシング)
同一遺伝子から複数のアイソフォームが生じることで、接着分子の構造・機能を多様化させる。
具体例:インテグリン(Integrin)ファミリー
- インテグリンαサブユニット(例:ITGA6遺伝子):
- 細胞外ドメインに複数のエクソンが存在し、オルタナティブ・スプライシングで細胞外マトリックス結合部位が変化。
- ITGA6A:ラミニン1特異的結合(上皮細胞基底膜接着)。
- ITGA6B:ラミニン5特異的結合(表皮細胞のヘミデスモソーム形成)。
- 結果:同一細胞で異なるECMとの接着特異性を持ち、組織特異的接着を実現。
2. 糖鎖修飾の多様性(Glycosylation)
同一コアタンパク質に多様な糖鎖が付加され、結合親和性・認識特異性が変化。
具体例:セレクトリン(Selectin)ファミリー
- Pセレクトリン(SELP):血小板・内皮細胞表面に発現。
- コアタンパク質は共通だが、シアルイル糖鎖(sialyl-Lewis X: sLeX)の有無・構造でリガンド認識が変わる。
- sLeX陰性Pセレクトリン:弱い結合(循環血液中)。
- sLeX陽性Pセレクトリン:高親和性結合(炎症時、白血球のローリング接着)。
- 結果:糖鎖酵素(FUT3, ST3GAL4など)の発現変化で、同じ分子が「待機状態」と「活性状態」を切り替え、炎症応答を制御。
まとめ:オルタナティブ・スプライシングはアミノ酸配列レベル、糖鎖修飾は翻訳後修飾レベルで接着分子多様性を生み、細胞の接着特異性・応答性を精密制御する。
カドへリンは細胞間での同種間相互作用をすることが知られている。同種間相互作用とは何か。また、それをEカドヘリンを用いた実験でどのように示すことができるか。
同種間相互作用とは
カドヘリンの同種間相互作用(homophilic interaction)とは、同じ種類のカドヘリン分子同士のみが特異的に結合する性質のことである。
カドヘリンはCa²⁺依存性の接着分子であり、EカドヘリンはEカドヘリンと、NカドヘリンはNカドヘリンとのみ安定した結合を形成する。
異なる種類のカドヘリン(EとNなど)では親和性が低く、接着しない。
この特異性によって、細胞は自分と同じタイプの細胞とだけ強く結びつき、発生過程における組織の選択的分離や層構築を可能にしている。
E-カドヘリン実験の方法
E-カドヘリンを発現させた細胞(例: 上皮細胞)と、N-カドヘリンを発現させた細胞を混合培養すると、同種のカドヘリン同士の相互作用により、E-カドヘリン細胞が塊になり、N-カドヘリン細胞が別の塊になる「細胞の棲み分け」が観察されます。 この実験は、1970年代にTakeichiらが開発したもので、カドヘリンの同種特異性を視覚的に証明します。
なぜこの実験が重要か
このような細胞の自己分類は、胚発生時の組織形成で鍵となり、カルシウムイオンが存在するとカドヘリンの結合が強まります。 高校生向けに言うと、友達同士で固まるように細胞が「自分と同じ仲間」を認識してくっつく仕組みです。
生物学的意義
この性質により、発生過程で異なる細胞集団が正しく分かれ、例えば外胚葉・中胚葉・内胚葉の組織境界形成や、神経上皮細胞の層構築など、複雑な組織分化が実現する。
つまり、カドヘリンは「細胞社会における自己識別コード」として機能している。
接着結合は、隣接した上皮細胞の側方面をつなぐ役割に加えて、細胞の形を制している。この役割に関与するタンパク質は何で、どのような構造をもつか。
接着結合(アドヘレンスジャンクション)で細胞の形を制御する主なタンパク質はカドヘリン(特にE-カドヘリン)で、細胞質側でカテニン複合体(α-カテニン、β-カテニン、p120カテニン)と結合し、アクチン細胞骨格に連結します。 これにより、隣接細胞間の張力や骨格の再編成を通じて細胞の形態を維持・制御します。
カドヘリンの構造
カドヘリンは膜貫通型タンパク質で、細胞外ドメインに5つのEC(Extracellular Cadherin)ドメインを持ち、これらが隣接細胞のカドヘリンと同種特異的に結合します。 細胞質ドメインはカテニンと結合し、アクチンフィラメントを固定して細胞の形を支えます。
細胞形制御の仕組み
カテニン複合体がアクチン骨格と連結することで、接着結合は機械的張力を感知し、細胞の伸長や収縮を調整します。 例えると、細胞の「ベルト」のように周囲を締め、形をキープする役割です。
密着結合の正常な機能は何か。密着結合が適切に働かないと、組織にどのようなことが起こりうるか。
密着結合の正常な機能
・隣接する上皮細胞間の細胞膜を密着させ、傍細胞経路による物質の透過を制限する(バリア機能)
・細胞膜中の脂質や膜タンパク質の側方拡散を防ぎ、細胞極性を維持する(フェンス機能)
これらの機能により、上皮組織は管腔側と基底側で異なる組成の細胞外環境を保持し、イオン・栄養素の選択的吸収や分泌を可能にします。
機能不全時の組織への影響
密着結合が適切に働かない場合、バリア機能の低下により有害物質や病原体が組織内に漏出して炎症や感染を引き起こし、フェンス機能の喪失により細胞極性が乱れて上皮組織の構造異常が生じます。 これにより、腸管ではリーキーガット症候群、腎臓では蛋白尿、脳では血液脳関門障害などの病態が進行し、組織の機能不全やがん転移を促進します。
コラーゲンとは何か、そしてこれはどのように合成されるか。コラーゲンが組織のまとまりに必要であることは何からわかるか。
コラーゲンとは
コラーゲンは動物の結合組織(皮膚、骨、腱)に豊富な線維状タンパク質で、生体内タンパク質の約30%を占めます。3本のポリペプチド鎖(α鎖)がGly-X-Y配列で三重らせん構造を形成し、組織に強靭さと弾力性を与えます。
コラーゲンの合成
線維芽細胞内でリボソームでプロα鎖が合成され、小胞体でプロリン・リジンがビタミンC依存的にヒドロキシ化されます。3本鎖が三重らせんを形成したプロコラーゲンがゴルジ体から細胞外へ分泌され、プロペプチダーゼで末端が切断されて成熟コラーゲン線維が重合します。
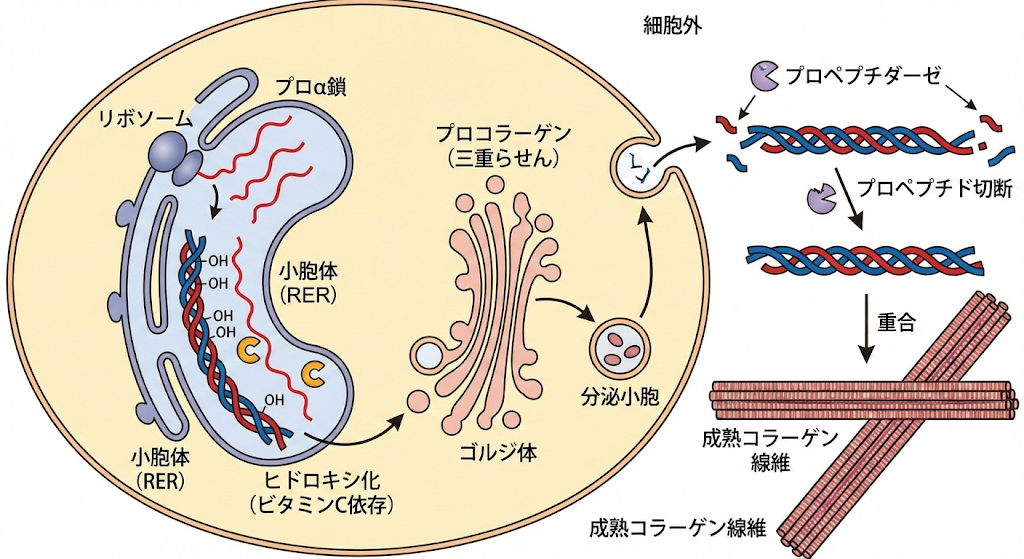
組織まとまりの必要性の証拠
骨形成不全症(I型コラーゲン遺伝子COL1A1/2変異)で骨が極端に脆弱化し頻発骨折が生じます。この疾患からコラーゲンが組織の機械的強度維持に不可欠であることが臨床・組織学的に証明されています。
構造モデルを用いて,インテグリンがどのように外から内へ、また内から外へのシグナル伝達を仲介しているかを説明せよ。
インテグリンの構造と基本モデル
インテグリンはα鎖とβ鎖からなるヘテロ二量体の膜貫通タンパク質で、大きく分けて「不活性型(曲がった構造)」と「活性型(伸びた構造)」の2つの状態をとります。この構造変化が「スイッチ」となり、細胞内外の双方向のシグナル伝達を仲介します。
内から外へのシグナル伝達(Inside-out signaling)
これは「細胞が接着能力を獲得するプロセス」です。
- 刺激: 細胞内のシグナル(例:増殖因子やサイトカイン刺激)によって、タリン(Talin)やキンドリン(Kindlin)などの細胞内タンパク質が活性化します。
- 結合と構造変化: タリンがインテグリンの細胞内ドメイン(β鎖の細胞質尾部)に結合すると、α鎖とβ鎖の細胞内ドメイン間の結合が解かれます。
- 伝播: この変化が膜を越えて細胞外ドメインに伝わり、インテグリン全体が「くの字」に折れ曲がった不活性型から、ピンと伸びた活性型へ構造変化します(スイッチブレードモデル)。
- 結果: 活性化したインテグリンは細胞外マトリックス(リガンド)と強く結合できるようになります。
外から内へのシグナル伝達(Outside-in signaling)
これは「細胞が環境情報を感知して反応するプロセス」です。
- リガンド結合: 活性化したインテグリンに細胞外マトリックス(コラーゲンやフィブロネクチンなど)が結合します。
- クラスタリング: リガンド結合をトリガーに、インテグリンが細胞膜上で集まり(クラスタリング)、局所的に高密度な接着斑を形成します。
- シグナル発信: インテグリンの細胞内ドメインに、FAK(接着斑キナーゼ)やSrcファミリーキナーゼなどのシグナル分子が動員され、活性化されます。
- 結果: これにより細胞骨格の再編成(アクチン重合など)、細胞増殖、分化、生存などのシグナルカスケードが細胞内へ伝わります。
ポイント
- 構造変化が鍵: 「曲がった状態(低親和性)」⇔「伸びた状態(高親和性)」の切り替えがすべての基本。
- 双方向性:
- Inside-out: 細胞内シグナル → 構造変化 → 接着ON(リガンド結合能獲得)
- Outside-in: リガンド結合 → クラスタリング → 細胞内応答(増殖・移動など)
すべての組織の細胞外マトリックスに多量に存在する3種類の巨大分子それぞれの機能と性質を比較せよ。
細胞外マトリックスの主要3成分
細胞外マトリックス(ECM)は主に以下の3種類の巨大分子で構成され、それぞれが異なる役割で組織を支えています。
1. プロテオグリカン (Proteoglycans)
【性質】
コアタンパク質に、非常に長い糖鎖であるグリコサミノグリカン(GAG)(例:ヒアルロン酸、コンドロイチン硫酸)が結合した分子。糖鎖がマイナスに帯電しているため、水を強力に引き寄せる性質(高い保水性)を持ちます。
【機能】
組織内で水和したゲル状の空間を作り出し、細胞外の隙間を埋めます。これにより組織に弾力性を与え、外部からの圧縮や衝撃に対するクッションの役割を果たします。また、成長因子などのシグナル分子を保持する働きもあります。
2. 線維状タンパク質 (Fibrous proteins)
【性質】
主にコラーゲンやエラスチンなどが該当します。コラーゲンは強靭なロープ状の構造(三重らせん)を持ち、エラスチンはゴムのような伸縮性を持ちます。
【機能】
組織に機械的な強度(引っ張り強度)と弾性を与えます。組織の形を維持し、力が加わっても壊れないように支える、いわば組織の「骨組み」です。
3. 糖タンパク質 (Glycoproteins)
【性質】
フィブロネクチンやラミニンなどが代表的です。これらは複数の結合部位を持つ「マルチアダプター」のような分子です。
【機能】
細胞表面の受容体(インテグリンなど)と、コラーゲンやプロテオグリカンなどの他のECM成分を橋渡し(接着)します。これにより、細胞をECMにつなぎ止めたり、細胞の移動(遊走)のガイド役となったりして、細胞の挙動を制御します。
ポイント
| 分子種 | 代表例 | 主な役割 | イメージ |
|---|---|---|---|
| プロテオグリカン | アグリカン、パールカン | 空間充填、衝撃吸収、保水 | 水を含んだスポンジ |
| 線維状タンパク質 | コラーゲン、エラスチン | 機械的強度、構造維持 | 頑丈なロープやゴム |
| 糖タンパク質 | フィブロネクチン、ラミニン | 細胞接着、架橋 | 接着剤やコネクター |
多くのプロテオグリカンには細胞のシグナル伝達の役割がある。その一例に、脳の視床下部におけるシンデカンによる摂餌行動の調節がある。この調節はどのように行われるか。
シンデカンによる摂食調節の概要
シンデカン(Syndecan-3)は視床下部において、摂食促進ペプチド(AgRP)などの働きを助ける共受容体(Co-receptor)として機能し、摂食行動を促進します。空腹時にシンデカン-3が増えると、摂食を促すシグナルが増強され、逆に満腹時にはこれが減少して過食を防ぐ調節が行われます。
調節の詳細メカニズム
- 共受容体としての作用
シンデカン-3のへパラン硫酸鎖は、摂食を促進する神経ペプチドAgRP(アグーチ関連タンパク質)と結合します。これによりAgRPが受容体(MC4R)の近くに濃縮され、効率よく結合できるようになります。 - メラノコルチン系の阻害
AgRPは、摂食を抑制するα-MSH(メラニン凝集ホルモン)が受容体(MC4R)に結合するのを邪魔する「アンタゴニスト(拮抗薬)」です。シンデカン-3がAgRPの働きを強めることで、結果として「摂食抑制」のシグナルがブロックされ、食欲が増進します。 - フィードバック調節
空腹時には視床下部でシンデカン-3の発現量が増加して摂食を促し、食事をしてエネルギーが充足すると発現量が低下します。この変動が、適切なエネルギーバランスの維持に寄与しています。
ポイント
- キー分子: シンデカン-3(膜貫通型プロテオグリカン)。
- 作用部位: 視床下部(摂食中枢)。
- 作用機序: AgRP(摂食促進因子)を集めてMC4R(摂食抑制受容体)への作用を強める=「ブレーキ(摂食抑制)を無効化する」ことで食欲を出す。
- 生理的意義: 空腹・満腹のサイクルに合わせて量が変化し、太りすぎや痩せすぎを防ぐ。
両側に別のアミノ酸を含むRGD配列をもつオリゴペプチドを合成した。培養皿にフィブロネクチンの層を吸着させてその上で育てた培養繊維芽細胞に,このペプチドを加えたときにどのような影響が現れるか。またその理由を説明せよ。
ペプチド添加の影響
フィブロネクチン上で培養している線維芽細胞に、RGD配列を含むオリゴペプチド(RGDペプチド)を溶液として大量に加えると、接着していた細胞が剥がれ、丸くなります(接着阻害)。
その理由
- 本来の結合メカニズム
線維芽細胞は、細胞膜上の受容体であるインテグリンが、培養皿上のフィブロネクチンに含まれるRGD配列(アルギニン-グリシン-アスパラギン酸)を認識して結合することで接着しています。 - 競合阻害(Competitive Inhibition)
溶液中にフリーのRGDペプチドを加えると、これらがインテグリンの結合ポケットに入り込み、本来結合するはずのフィブロネクチンとインテグリンの結合を「横取り」してしまいます。 - 接着の解除
フリーのRGDペプチドは培養皿(足場)に固定されていないため、インテグリンがこれと結合しても細胞を支えることはできません。その結果、細胞は足がかりを失い、培養皿から剥離してしまうのです。
ポイント
- RGD配列: フィブロネクチンなどの細胞外マトリックスに含まれる、インテグリンが認識する特定の3アミノ酸配列。
- 現象: 可溶性RGDペプチド添加 → 細胞接着の阻害・剥離。
- 原理: 競合阻害。インテグリンが「ニセモノ(加えたペプチド)」に塞がれて、「ホンモノ(床のフィブロネクチン)」をつかめなくなるから。
血液凝固は、哺乳類の生存のために必須な機能である。フィブロネクチンの多価接着能は、どのように血小板を凝固塊に集めるのか。
フィブロネクチンの役割
フィブロネクチンは、血液凝固の過程において「分子の橋渡し役」として機能します。その多価接着能(複数の異なる分子と同時に結合できる能力)を利用して、血小板を凝固塊(フィブリン血栓)に強力に固定します。
血小板を集めるメカニズム
- フィブリンへの結合(土台の確保)
凝固反応によって作られたフィブリン網(凝固塊の骨格)に対し、フィブロネクチンはその固有の「フィブリン結合ドメイン」を使って結合し、網目構造の一部となります。 - 血小板への結合(アンカリング)
同時に、フィブロネクチンは別の場所にある「細胞結合ドメイン(RGD配列)」を使って、活性化した血小板表面のインテグリン($\alpha_{IIb}\beta_3$など)と結合します。 - 橋渡しによる固定
この二重の結合により、フィブロネクチンは「フィブリン網」と「血小板」を物理的につなぐ架け橋(クロスリンカー)となります。これにより、血流で流されそうな血小板を凝固塊の中にしっかりとつなぎ止め、血栓の強度を高めながらさらに多くの血小板を集積させます。
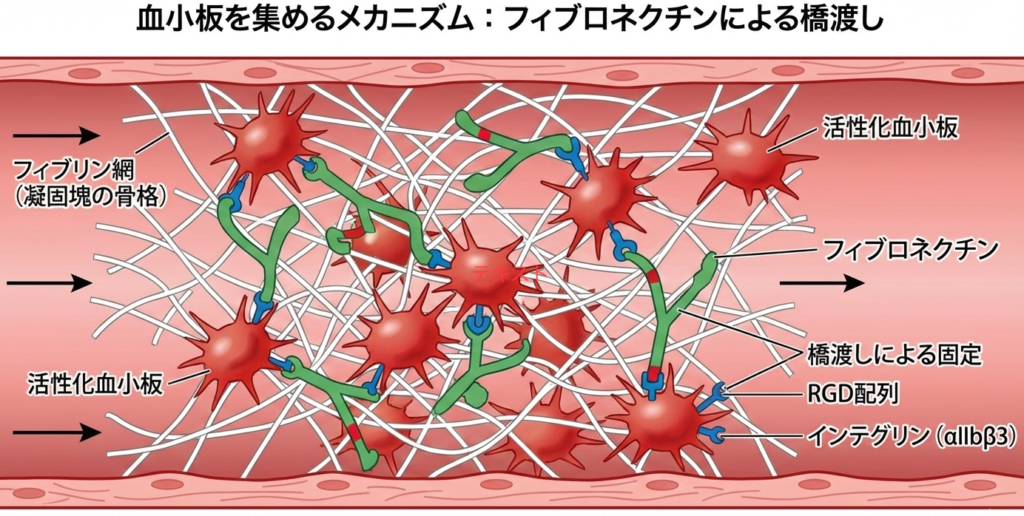
ポイント
- 多価接着能: 1つの分子内に「フィブリン結合部位」「コラーゲン結合部位」「細胞(血小板)結合部位」など、複数の結合サイトを持つ性質。
- 結合の連鎖: フィブリン(網) ⇔ フィブロネクチン(接着剤) ⇔ インテグリン(血小板の取っ手)。
- 結果: 血小板がフィブリン網に取り込まれ、頑丈な止血血栓が完成する。
細胞外マトリックスと細胞骨格の分子的な連結が変化すると、どのようにデュシェンヌ型筋ジストロフィーがひき起こされるのか。
病態の発症メカニズム
正常な状態:強固な連結
正常な筋細胞では、ジストロフィンという巨大なタンパク質が「アンカー(錨)」の役割を果たしています。ジストロフィンは、細胞の内側で細胞骨格(アクチンフィラメント)につかまり、細胞膜を貫通して、外側の細胞外マトリックス(ラミニンなど)へとつながる「ジストロフィン・糖タンパク質複合体(DGC)」を形成しています。この一連の連結が、筋肉が激しく収縮・弛緩する際の物理的なストレスから細胞膜を守っています。
デュシェンヌ型筋ジストロフィー:連結の破綻
この病気では、遺伝子変異によりジストロフィンが全く作られません(欠損)。
- アンカーの消失: 細胞骨格と細胞外マトリックスをつなぐ鎖が切れた状態になります。
- 細胞膜の脆弱化: 筋収縮の力が細胞膜に直接ダメージを与え、膜が簡単に裂けてしまいます(細胞膜の安定性低下)。
- カルシウムの流入と壊死: 裂けた膜からカルシウムイオンが過剰に流入し、タンパク質分解酵素が活性化されて筋細胞自体を分解・壊死させます。
- 再生の限界と線維化: 壊死と再生を繰り返すうちに再生能力が枯渇し、筋肉が脂肪や線維組織(結合組織)に置き換わってしまい、筋力が失われます。
ポイント
- 責任分子: ジストロフィン(細胞骨格とECMをつなぐコネクター)。
- 構造的欠陥: 内(アクチン)⇔ 膜 ⇔ 外(ECM)の物理的連結が失われる。
- 結果: 筋収縮の機械的ストレスに耐えられず、細胞膜が破損 → 細胞死。
補足
この連結は「ショックアブソーバー(衝撃吸収装置)」のようなものです。それがなくなると、筋肉を動かすたびに自分の力で自分自身を傷つけてしまうことになります。これが進行性の筋力低下の根本原因です。
白血球は、感染防衛のために血液中から感染部へと速やかに移動する。この過程は何とよばれているか。また、この過程に接着分子はどのようにかかわっているか。
白血球の遊走(Leukocyte extravasation)
この過程は遊走(ゆうそう)または血管外遊出(けっかんがいゆうしゅつ)と呼ばれます。白血球は、炎症部位から出される誘引物質(ケモカイン)を感知し、血管の壁をすり抜けて感染部位へと向かいます。
接着分子のかかわり
この遊走は、白血球と血管内皮細胞それぞれの表面にある「接着分子」の連携プレーによって、以下の3段階で進行します。
- ローリング(回転)
白血球表面の糖鎖と、血管内皮細胞上のセレクチン(Selectin)が弱く結合したり離れたりを繰り返します。これにより、白血球は血流に流されながらも血管壁の上を転がるように減速します。 - 活性化と強固な接着
炎症部位からのシグナルで、白血球上のインテグリン(Integrin)が活性化(構造変化)します。この活性化したインテグリンが、血管内皮細胞上のICAM(アイカム)などのリガンドとガッチリ結合し、白血球は血管壁にピタリと停止します。 - 血管外通過
停止した白血球は、血管内皮細胞の隙間を押し広げるようにして血管の外へ抜け出します(PECAMなどが関与)。
ポイント
- 過程の名前: 遊走(Extravasation)。
- ステップ: ローリング(減速)→ 接着(停止)→ 通過(脱出)。
- 主役の分子:
- セレクチン: 「ゆるい結合」でブレーキをかける。
- インテグリン: 「強い結合」でアンカーを降ろして止まる。
植物の細胞壁の構造は、細胞を成長させるために緩む必要がある。この過程を制御するシグナル伝達分子は何か。
制御するシグナル伝達分子
この過程を制御する主なシグナル伝達分子は、植物ホルモンのオーキシン(Auxin / インドール-3-酢酸)です。オーキシンが細胞壁を緩める一連の反応の「引き金」となります。
細胞壁が緩むメカニズム(酸成長説)
- プロトンポンプの活性化
オーキシンが細胞膜上の受容体に結合すると、細胞膜にあるプロトンポンプ(H⁺-ATPase)が活性化されます。これにより、細胞内から細胞壁側へ水素イオン(H⁺)が放出されます。 - 細胞壁の酸性化
放出されたH⁺によって、細胞壁のpHが酸性(pH 4.5〜5.5程度)に低下します。 - エクスパンシンの活性化
この酸性環境が、細胞壁にあるタンパク質エクスパンシン(Expansin)を活性化させます。エクスパンシンは、細胞壁のセルロース繊維同士を結びつけている水素結合を断ち切る働きをします。 - 細胞壁の弛緩と成長
結合が切れることで、堅牢だったセルロースネットワークが緩み、細胞内の膨圧(turgor pressure)によって細胞壁が引き伸ばされ、細胞が成長(伸長)します。
ポイント
- シグナル分子: オーキシン(司令塔)
- 実行分子: エクスパンシン(実際に壁を緩めるタンパク質)
- 鍵となる反応: 酸性化(pH低下がスイッチになる)
植物細胞の原形質連絡と動物細胞のギャップ結合を比較せよ。
共通点
どちらも隣り合う細胞同士をつなぐ「トンネル」の役割を果たし、細胞質を連続させることで、イオンや低分子物質(アミノ酸、糖、シグナル分子など)を直接やり取りする連絡結合(communicating junction)として機能します。
相違点
| 特徴 | 植物:原形質連絡 (Plasmodesmata) | 動物:ギャップ結合 (Gap junction) |
|---|---|---|
| 構造の基本 | 細胞膜が連続した管状構造で、細胞壁を貫通する。 | コネキシンという膜タンパク質が集まってできた管(コネクソン)が、隣接細胞の膜同士をつなぐ。 |
| 内部の構造 | 中心に小胞体由来のデスモ小管(Desmotubule)が通っている。 | タンパク質でできた単純なトンネル構造(中空)。 |
| 通過できる分子 | 通常は低分子だが、必要に応じて拡張し、巨大なタンパク質やRNA(ウイルス含む)も通過可能。 | イオンや小さな分子(約1kDa以下)しか通さない。巨大分子は通過不可。 |
| 形成時期 | 主に細胞分裂時に細胞板が作られる際に形成される(後から作られる場合もある)。 | 細胞膜上にいつでも形成・消失が可能(動的)。 |
ポイント
- 植物の特殊性: 植物細胞は厚い細胞壁に囲まれているため、単なる穴ではなく、細胞膜そのものが隣の部屋とつながっている(家の壁をぶち抜いて廊下でつないだ状態)のが最大の特徴です。
- 動物のシンプルさ: 動物細胞は膜同士が密着できるため、専用のパイプ(タンパク質)を差し込んでつなぐ(壁に小さな換気扇の穴を通した状態)イメージです。
- 機能の差: 植物の原形質連絡は、ウイルスなどの大きな分子も通れる「物流ルート」としても使われますが、動物のギャップ結合は主に「通信回線(電気的・化学的結合)」としての役割が強いです。
問題文引用元:東京化学同人 分子細胞生物学 第6版


コメント