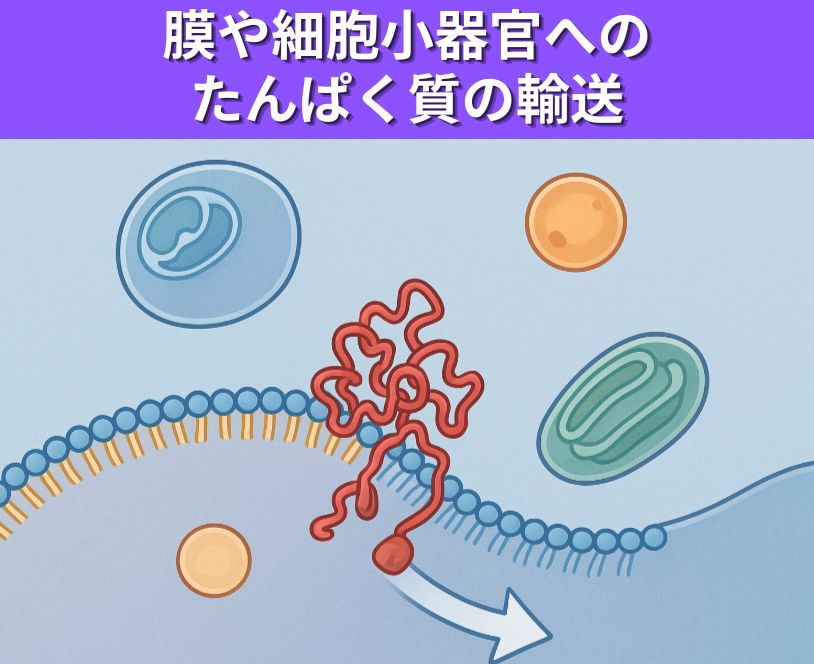
- a)小胞体への翻訳時輸送,b)小体への翻訳後輸送,c)細菌の細胞膜を横切っての輸送、および, d)ミトコンドリアマトリックスへの輸送において、膜を横切って一方向性輸送を行うために必要なエネルギー源について述べよ。
- 多くの細胞小器官への輸送には、一つあるいは複数の細胞質タンパク質の働きが必要である。小胞体、ミトコンドリア、およびペルオキシソームへの輸送に必要な細胞質因子の基本的機能をそれぞれについて述べよ。
- タンパク質中の空間配置決定配列を同定するための原則とそれを使ったコンピュータープログラム(アルゴリズム)の開発について述べよ。空間配置決定配列が同定できると、どのようにして複数回膜貫通型タンパク質の膜内での配置が予測できるのか。 シグナルー膜係留配列に対して正電荷をもったアミノ酸の配列がどちらにくるかということが膜内での方向を決める上でどのように重要なのか。
- 新たに合成されたタンパク質の“品質管理”に小胞体は重要な役割を果たしている。ここでいう品質管理とはどのようなことか。新たにつくられたタンパク質が小胞体内でプロセシングされるときにどのようなアクセサリータンパク質が関与するのか。細胞は小胞体から出られなくなったタンパク質を分解する。細胞内のどこでその分解が行われ、Sec61 タンパク質からなるトランスロコンとp97はその分解過程にどう関与するのか。
- N結合型オリゴ糖の前駆体であるドリコールオリゴ糖の合成の各段階の酵素が阻害される温度感受性突然変異酵母が単離されている。ドリコールーPP-(GIcNAc)2-Man5という中間体の合成が阻害されている突然変異体では分泌タンパク質へのN結合型オリゴ糖鎖の付加が全く起こらないが、この中間体が完成した前駆体であるドリコールーPP-(GIcNAc)2Man9 Glc3になる段階が阻害されている変異体では分泌タンパク質への糖鎖付加が起こることを説明せよ。
- 小胞体内腔で分泌タンパク質の修飾や折りたたみを促している四つの異なるタンパク質の名前をあげよ。それらのタンパク質を、基質タンパク質を共有結合により修飾するものと基質タンパク質の立体構造を変えるだけのものに分けよ。
- 特定のタンパク質の小胞体内での折りたたみに興味をもち、小胞体抽出液中の新たに合成されたばかりのそのタンパク質にBiPが結合するかどうか調べた。その結果、抽出液に ADP を加えると新たに合成された分泌タンパク質は BiPと結合しており、ATP を加えると結合しないことがわかった。基質タンパク質とBiPの結合機構に基づき、この結果を説明せよ。
- 次のようなミトコンドリア変異体においてミトコンドリアマトリックスタンパク質前駆体はどうなるのか。a)シグナル受容体 Tom22に変異が起こっている。b)シグナル受容体Tom70に変異が起こっている。c)マトリックス内のHsc70に変異が起こっている。d) マトリックス内のシグナルペプチダーゼに変異が起こっている。
- ミトコンドリアマトリックスと葉緑体ストロマへの取込みの類似点と相違点を述べよ。
- ミトコンドリアマトリックスタンパク質前駆体とジヒドロ葉酸レダクターゼ (DHFR)を融合させたキメラタンパク質を使い、前駆体タンパク質がどのくらいマトリックス内に入ったところでマトリックス輸送配列が内部のプロテアーゼによって切断されるかを決める実験を計画せよ。
- ミトコンドリアや葉緑体への輸送では、それぞれの細胞小器官内でさらに複数の部位への選別が行われている。それらの部位の名称をあげよ。ミトコンドリアを例とし、ADP/ATP対向輸送体とシトクロム b2の場合を比較したとき、それらが固有の部位に送り込まれる際にどれだけ共通の機構を使っているかを示せ。
- ペルオキシソームには酸素分子を使ってさまざまな基質を酸化する酵素が存在するが、その過程で過酸化水素が発生し、それは分解しなければならない。過酸化水素を分解する酵素の名前は何か.その酵素をペルオキシソームに送り込む機構とそのさいに結合するタンパク質はどのようなものか。
- 機能をもつペルオキシソームを失った新しい変異体を同定したとする。この変異体の欠陥がおもに膜の形成とタンパク質の埋め込みにあるのか、それともマトリックスタンパク質の取り込みにあるのかを実験的に決めるにはどうしたらよいかについて述べよ
- 本章で述べてきた多くの証拠から、膜を通り抜けてタンパク質を細胞小器官内に送り込むにはポリペプチド鎖内に特殊な配列が必要であることが明らかになった。40kDa以上のタンパク質の核への輸送もその点は同じで,核膜孔複合体を通って能動的に輸送されている、高分子を核へ特異的に輸送するために必要なアミノ酸配列にはどのような名前がつけられているか。そのさいに必要とされる3種類のタンパク質の名前をあげ、それらがどのように働くのかを簡単に述べよ。
- NES を含む積み荷タンパク質の一方向的輸送にとって、Ran-GAPの核局在性,およびRan-GEF の細胞質局在性がなぜ必要なのか。
a)小胞体への翻訳時輸送,b)小体への翻訳後輸送,c)細菌の細胞膜を横切っての輸送、および, d)ミトコンドリアマトリックスへの輸送において、膜を横切って一方向性輸送を行うために必要なエネルギー源について述べよ。
どの経路もATPやGTPなど高エネルギーリン酸化合物の加水分解を利用し、分子ラチェット、シャペロン、トランスロコン機構等による一方向性を実現しています。以下に、各輸送経路で膜を一方向に横切る輸送のために必要なエネルギー源をまとめます。
a)小胞体への翻訳時輸送(共翻訳輸送)
- 主なエネルギー源:リボソームによるポリペプチド鎖合成自体に伴うGTP/ATP加水分解
- ポリペプチド合成の進行が、そのままタンパク質をトランスロコン経由で小胞体内腔や膜へ「押し出す」駆動力となる。
- シグナル認識粒子(SRP)の結合・解離にもGTPの加水分解エネルギーが使われる。
b)(ミトコンドリアなどの)小器官への翻訳後輸送
- 主なエネルギー源:シャペロンによるATP加水分解
- 細胞質側シャペロン(Hsp70など)がATP加水分解でポリペプチドを伸展状態に保ち、小器官内の(例:ミトコンドリアマトリックスHsp70)がATP駆動で「引き込む」ラチェット機構で一方向性を実現。
c)細菌細胞膜を横断するタンパク質輸送
- 主なエネルギー源:SecAタンパク質のATP加水分解、またはリボソーム合成エネルギー
- Sec経路ではSecA ATPaseのATP加水分解(翻訳後)や、翻訳共役の場合はリボソーム合成からの力(GTP/ATP)で膜を横断。
d)ミトコンドリアマトリックスへの輸送
要点まとめ
- いずれもエネルギー供給としてATPやGTP加水分解(+膜電位)がタンパク質の一方向的通過を担保している。
- シャペロン系、翻訳時伸長エネルギー、ATPase、膜電位などそれぞれの特徴的メカニズムによって分子が逆戻りせずに輸送される。
多くの細胞小器官への輸送には、一つあるいは複数の細胞質タンパク質の働きが必要である。小胞体、ミトコンドリア、およびペルオキシソームへの輸送に必要な細胞質因子の基本的機能をそれぞれについて述べよ。
小胞体、ミトコンドリア、ペルオキシソームへのタンパク質輸送に必要な細胞質因子の基本的な機能について整理します。
小胞体への輸送に必要な細胞質タンパク質の機能
- **シグナル認識粒子(SRP)**が主な細胞質因子です。
- SRPは、合成中ポリペプチドのN末端シグナル配列を認識し、リボソーム・mRNA複合体を小胞体膜へ誘導することが主な役割です。
- SRPがGTP加水分解を介し、SRP受容体と連携してリボソームをトランスロコン(Sec61複合体)にリクルートし、小胞体内腔へタンパク質の一方向的輸送を開始させます。
ミトコンドリアへの輸送に必要な細胞質タンパク質の機能
- 主にHsp70シャペロンなどの細胞質シャペロン分子が重要です。
- これらは、合成直後の未折りたたみ(アンフォールディング)状態のタンパク質を変性や凝集から守り、輸送可能な伸展状態で保持します。
- 輸送シグナルを持つタンパク質の認識や、ミトコンドリア膜トランスロカーゼ複合体(TOM複合体)への搬送を担い、エネルギー源(ATP加水分解)を使って輸送効率と一方向性を確保します。
ペルオキシソームへの輸送に必要な細胞質タンパク質の機能
- 主な因子は**ペキシンファミリー(Pexタンパク質、特にPex5・Pex19など)**です。
- Pex5はペルオキシソーム標的配列(PTS1等)を持つタンパク質を細胞質で直接認識して搬送し、ペルオキシソーム膜で受容体と結合させる役割があります。
- Pex19は膜タンパク質のシャペロンや搬送因子として、細胞質でペルオキシソーム膜タンパク質(PMP)を保護・結合して正しい膜への配送を介助します。
- 必要に応じて、小胞体などから新生ペルオキシソームへの小胞輸送にも関与します。
まとめ表
| 細胞小器官 | 主な細胞質因子 | 基本的な機能 |
|---|---|---|
| 小胞体 | SRP | シグナル配列認識・膜への搬送 |
| ミトコンドリア | Hsp70シャペロン | 変性防止・伸展保持・膜複合体への受け渡し |
| ペルオキシソーム | Pex5/Pex19(他Pex群) | 標的配列認識・シャペロン・搬送・膜配送調節 |
これらの因子は、ターゲットタンパク質を識別し、正しいオルガネラへ選択的に送り込むために不可欠な役割を果たしています。
タンパク質中の空間配置決定配列を同定するための原則とそれを使ったコンピュータープログラム(アルゴリズム)の開発について述べよ。空間配置決定配列が同定できると、どのようにして複数回膜貫通型タンパク質の膜内での配置が予測できるのか。 シグナルー膜係留配列に対して正電荷をもったアミノ酸の配列がどちらにくるかということが膜内での方向を決める上でどのように重要なのか。
1. 空間配置決定配列の同定原則とアルゴリズム開発
- 膜貫通タンパク質の空間配置(トポロジー)は、アミノ酸配列に含まれる疎水性領域が膜貫通ヘリックスとなることに基づき予測されます。
- 疎水性が高い配列断片を検出し、それを膜貫通領域の候補と判定する方法が基本です。
- さらに、膜の内外の環境や機能による特徴的なアミノ酸配置(例えば、正電荷アミノ酸の偏り)も解析に重要です。
- これらの原則をもとに、滑動窓法によるヒドロパシープロット、隠れマルコフモデル(HMM)、機械学習や深層学習を用いたプログラム(例:TMHMM、Phobius、AlphaFoldなど)が開発されています。
2. 空間配置決定配列の同定が膜内配置予測に役立つ理由
- 複数回膜貫通型タンパク質では、複数の疎水性ヘリックスが連続し、それらが膜を何度も貫通する形で配置されています。
- 同定した疎水性領域の位置関係と、膜の両面でのアミノ酸スキュー(配置の偏り)から、どのヘリックスがどの向きで膜を横断するかを予測します。
- これにより、タンパク質の膜内での全体的な構造(どの側が細胞質側か、細胞外側かなど)がわかります。
3. シグナルや膜係留配列における正電荷アミノ酸の重要性
- 「positive-inside rule」という法則では、膜タンパク質の細胞質側(膜の内側)に正に帯電するアミノ酸(リシン Lys、アルギニン Arg)が多く存在する傾向があります。
- この偏りは膜貫通ヘリックスの向きを決める際の指標として重要です。
- つまり、疎水性の膜貫通領域を挟む配列で、正電荷を持つアミノ酸が多い側が細胞質側に向くと予測されるため、タンパク質の膜に対する向きを正確に決定できます。
- シグナル配列や膜係留配列でも正電荷の配置によって、タンパク質の膜挿入方向や積込みの向きが制御されています。
新たに合成されたタンパク質の“品質管理”に小胞体は重要な役割を果たしている。ここでいう品質管理とはどのようなことか。新たにつくられたタンパク質が小胞体内でプロセシングされるときにどのようなアクセサリータンパク質が関与するのか。細胞は小胞体から出られなくなったタンパク質を分解する。細胞内のどこでその分解が行われ、Sec61 タンパク質からなるトランスロコンとp97はその分解過程にどう関与するのか。
小胞体におけるタンパク質の“品質管理”とは
新しく合成されたタンパク質は、正しく折りたたまれ、機能的な立体構造をとらなければなりません。小胞体(ER)はこの折りたたみ過程の場であり、不完全または誤った折りたたみタンパク質を識別し、正常なタンパク質だけが次の経路に進むよう制御する機能を「品質管理」と呼びます。
小胞体内でのタンパク質プロセシングに関与するアクセサリータンパク質
- シャペロンタンパク質(BiPなど): 新しく合成されたポリペプチド鎖の折りたたみを助け、誤った折りたたみを防止する。
- 糖鎖修飾酵素やカルレティキュリン系: 糖タンパク質の折りたたみや品質管理に関与する。
- タンパク質変異修復系: 折りたたみ異常タンパク質を修正しようと試みる。
分解の場と分解過程におけるSec61トランスロコンとp97の役割
- 誤った折りたたみや修復不能なタンパク質は「ER関連分解系(ERAD)」として知られる機構で分解されます。
- 分解は主にプロテアソームという細胞質の装置で行われるため、分解対象タンパク質は小胞体から細胞質側に逆輸送される必要があります。
- Sec61トランスロコンは本来タンパク質の小胞体への挿入を担いますが、ERADでは逆に誤ったタンパク質を小胞体内から細胞質へ送り出すチャネルとしても機能します。
- 逆輸送されたタンパク質は細胞質でユビキチン修飾を受け、**p97(あるいはVCP)**がATP依存的に物理的に引き出し、プロテアソームへと運びます。
まとめると、小胞体の品質管理では折りたたみ補助因子が関与し、異常タンパク質はSec61を通じて細胞質に逆輸送され、p97の助けを借りてプロテアソームに分解されます。これにより細胞内のタンパク質の品質が維持されています。
N結合型オリゴ糖の前駆体であるドリコールオリゴ糖の合成の各段階の酵素が阻害される温度感受性突然変異酵母が単離されている。ドリコールーPP-(GIcNAc)2-Man5という中間体の合成が阻害されている突然変異体では分泌タンパク質へのN結合型オリゴ糖鎖の付加が全く起こらないが、この中間体が完成した前駆体であるドリコールーPP-(GIcNAc)2Man9 Glc3になる段階が阻害されている変異体では分泌タンパク質への糖鎖付加が起こることを説明せよ。
ドリコールオリゴ糖合成の基礎
N結合型糖鎖の前駆体であるドリコールオリゴ糖は、ドリコールリン酸にN-アセチルグルコサミン(GlcNAc)、マンノース(Man)、およびグルコース(Glc)が段階的に付加されていくことで合成されます。まず、ドリコール-PP-(GlcNAc)2-Man5という中間体が小胞体膜の内側で形成されます。これが糖鎖の“コア”となる構造の基本部分です。
糖鎖付加に必要な基礎構造
分泌タンパクへのN結合型糖鎖の付加は、オリゴ糖転移酵素(OST)により成熟したドリコール-PP-(GlcNAc)2-Man9-Glc3がアスパラギン残基に一括転移されることで起こります。したがって、Man9のコア構造が完成していることが糖鎖付加の前提条件です。
突然変異体の現象の説明
- ドリコール-PP-(GlcNAc)2-Man5の合成が阻害される突然変異体では、基礎となる中間体そのものが存在しないため、糖鎖の付加に必要な前駆体が欠如し、分泌タンパク質に糖鎖は全く付加されません。
- これに対し、ドリコール-PP-(GlcNAc)2-Man9-Glc3への変換段階が阻害される突然変異体(つまり後期の修飾段階が妨げられている場合)では、Man9のコア糖鎖が完成しているため、糖鎖転移酵素は糖鎖をアスパラギンに付加できます。このため、分泌タンパク質には糖鎖が付加されますが、その後のグルコースなどの修飾が不完全となります。
まとめると、N結合型糖鎖の付加には基礎コア構造の完成が不可欠であり、それがなければ糖鎖は付加されませんが、修飾の後半段階での障害は糖鎖付加に直接影響しません。このことが突然変異体の違いによる現象を説明しています。
小胞体内腔で分泌タンパク質の修飾や折りたたみを促している四つの異なるタンパク質の名前をあげよ。それらのタンパク質を、基質タンパク質を共有結合により修飾するものと基質タンパク質の立体構造を変えるだけのものに分けよ。
小胞体内腔で分泌タンパク質の修飾や折りたたみを促している四つの異なるタンパク質について
小胞体内腔は分泌タンパク質の適切な修飾と正しい折りたたみを助ける重要な場です。ここで作用する代表的な四つのタンパク質を挙げ、それらを基質タンパク質を共有結合で修飾するものと、立体構造を変えるだけのものに分類します。
四つの代表的なタンパク質
- オリゴ糖転移酵素(OST;Oligosaccharyltransferase)
- プロテインジスルフィドイソメラーゼ(PDI;Protein Disulfide Isomerase)
- カルレティキュリン(Calreticulin)
- BiP(Binding immunoglobulin Protein)
共有結合により基質タンパク質を修飾するもの
- オリゴ糖転移酵素(OST)
→ 分泌タンパク質のアスパラギン残基に対してN結合型オリゴ糖を共有結合で付加する。
(N-グリコシル化を直接触媒) - プロテインジスルフィドイソメラーゼ(PDI)
→ システイン残基間のジスルフィド結合形成・還元・異性化を共有結合的に媒介し、正しい二硫化結合を形成させる。
立体構造を変えるだけのもの(共有結合を形成しないもの)
- カルレティキュリン(Calreticulin)
→ 糖鎖に結合し、基質タンパク質の折りたたみをサポート(シャペロン機能)。共有結合は形成しない。 - BiP (Hsp70ファミリーのシャペロン)
→ 基質ポリペプチドに非共有結合的に結合して折りたたみや品質管理を助ける。
これらのタンパク質は、それぞれ修飾やシャペロン作用を通じて、新生タンパク質の正しい構造形成と品質管理に寄与しています。
特定のタンパク質の小胞体内での折りたたみに興味をもち、小胞体抽出液中の新たに合成されたばかりのそのタンパク質にBiPが結合するかどうか調べた。その結果、抽出液に ADP を加えると新たに合成された分泌タンパク質は BiPと結合しており、ATP を加えると結合しないことがわかった。基質タンパク質とBiPの結合機構に基づき、この結果を説明せよ。
BiP(Binding immunoglobulin Protein)は小胞体内で働く主要な分子シャペロン(Hsp70ファミリー)であり、新しく合成されたタンパク質が適切に折りたたまれる過程を補助しています。BiPの基質タンパク質への結合と解離は、BiPがどのヌクレオチド(ATPかADP)と結合しているかによって制御されています。
- ADP存在下:BiPは基質(新たに合成されたタンパク質)に「高親和性」でしっかり結合します。BiPがADP型コンフォメーションだと、基質結合ドメインの「蓋」が閉じて、タンパク質を強く保持します。これにより、未完成なタンパク質が早期に折りたたまれることや誤った立体構造になることを防ぎます。
- ATP存在下:BiPは基質に「低親和性」となり、結合したタンパク質をすぐに放します。ATPが結合していると、基質結合ドメインの蓋が開き、BiPは基質を解離させます。これにより、折りたたみが進んだタンパク質はシャペロンから解放され、自由にフォールディングを完了できます。
このATPアーゼサイクルによって、BiPは基質タンパク質と結合⇄解離を繰り返し、適切なタイミングでタンパク質を監督・安定化させているのです。
ADPで結合、ATPで離れるという性質こそ、タンパク質フォールディングをダイナミックに調節する基盤となっています。
次のようなミトコンドリア変異体においてミトコンドリアマトリックスタンパク質前駆体はどうなるのか。a)シグナル受容体 Tom22に変異が起こっている。b)シグナル受容体Tom70に変異が起こっている。c)マトリックス内のHsc70に変異が起こっている。d) マトリックス内のシグナルペプチダーゼに変異が起こっている。
a)シグナル受容体 Tom22に変異が起こっている場合
Tom22はミトコンドリア外膜上のTOM複合体の主要な受容体で、ほとんどの核エンコード型ミトコンドリアタンパク質前駆体の輸送のはじめに認識機能を担います。
Tom22に変異があると前駆体タンパク質がTOM複合体に認識されにくくなり、ミトコンドリア内への輸送が著しく阻害されます。このため、ほとんどのマトリックスタンパク質前駆体は細胞質に滞留し、ミトコンドリア内に入ることができません。
b)シグナル受容体Tom70に変異が起こっている場合
Tom70はTOM複合体とは別に、大型や多ドメイン型前駆体タンパク質で、特に分子シャペロン経由で輸送されるタイプの前駆体の受容体です。
Tom70に変異がある場合、シャペロン依存型(一部の生合成酵素や輸送体タンパク質など)は細胞質に残り輸送できませんが、Tom22経由で認識される前駆体は、依然としてミトコンドリアに輸送できます。つまり、特定の前駆体のみの輸送障害となります。
c)マトリックス内のHsc70に変異が起こっている場合
ミトコンドリアマトリックスのHsc70(mtHsp70)はTIM複合体からマトリックスへの前駆体の引き込み(translocation)に不可欠です。
Hsc70に異常があると、前駆体はTOMとTIMを一部は通過できても、マトリックス内に完全に移動できず、膜上に中途停滞したり完全な輸送が妨げられてしまいます。通常は翻訳後にHsc70が作動することで、タンパク質は完全にマトリックス内に到達します。
d)マトリックス内のシグナルペプチダーゼに変異が起こっている場合
シグナルペプチダーゼはマトリックス内に輸送された前駆体タンパク質のN末端ターゲティング配列(ミトコンドリア標的シグナル)を切断し、成熟型タンパク質へと加工します。
この酵素に異常がある場合、マトリックス内に前駆体としては入れるものの、シグナル配列が除去されず未熟なまま残ります。その結果、成熟機能をもつタンパク質にはなれず、不活性化されたり異常タンパク質として分解されることもあります。
ミトコンドリアマトリックスと葉緑体ストロマへの取込みの類似点と相違点を述べよ。
類似点
- 核で合成される移行タンパク質の取込み
どちらも、核のDNAから転写・翻訳されたタンパク質が細胞質で合成され、移行シグナル(標的配列)によってオルガネラへ輸送されます。 - 二重膜の通過と専用複合体の利用
ミトコンドリアは外膜・内膜、葉緑体は外包膜・内包膜という二重膜を持ち、タンパク質移行にはそれぞれ専用のトランスロケーター(ミトコンドリアはTOM・TIM複合体、葉緑体はTOC・TIC複合体)を介して運ばれます。 - 移行後のシグナル配列切断
どちらも、内部への移行後にシグナル配列が酵素(ペプチダーゼ)で切断され、成熟型タンパク質となります。
相違点
- シグナル配列・認識機構の違い
ミトコンドリアと葉緑体で標的シグナルの一次構造や認識方法に違いがあり、それぞれ独自の移行シグナルや受容体を持ちます。 - 通過する膜の違い
ミトコンドリアはTOM→TIMを順に通過、葉緑体はTOC→TICを順に通過します。また葉緑体では追加の膜(チラコイド)に再び移行するタンパク質もあり、経路がより多様です。 - エネルギー源やシャペロンの使い方の違い
ミトコンドリアではHsp70などATP依存的なシャペロン活用が主役ですが、葉緑体では複数種のGTP分解酵素や異なるシャペロンも関与します。
このように両者は細胞質合成タンパク質の標的化、二重膜通過、ペプチドシグナル切断など基本戦略は類似しますが、個別の通路や分子的仕組みには相違があります。
ミトコンドリアマトリックスタンパク質前駆体とジヒドロ葉酸レダクターゼ (DHFR)を融合させたキメラタンパク質を使い、前駆体タンパク質がどのくらいマトリックス内に入ったところでマトリックス輸送配列が内部のプロテアーゼによって切断されるかを決める実験を計画せよ。
実験の前提
ミトコンドリアのマトリックスへ輸送されるタンパク質の前駆体は、N末端に「ミトコンドリア標的配列(presequence)」と呼ばれるシグナル配列をもっています。この配列は、タンパク質をミトコンドリア内に導く役割を果たします。
この配列は、マトリックス内のプロテアーゼ(シグナルペプチダーゼ)**によって切断されることで、タンパク質の“輸送完了”がわかります。
使用するのは、次の**キメラタンパク質(融合タンパク質)**です。
- ミトコンドリアマトリックス蛋白質前駆体(Precursor):ミトコンドリア内に運ばれる能力を持つ。
- DHFR(ジヒドロ葉酸レダクターゼ):細胞質で折り畳まれる性質をもつ安定な酵素。
これらを融合して1つにしたキメラタンパク質を使います。
実験計画の概要
- キメラタンパク質の設計
ミトコンドリア標的シグナル(マトリックス輸送配列)をN末端に、DHFRをその後ろに連結した融合タンパク質(プレカーサー-DHFR)を作製する。 - DHFR活性阻害剤(メトトレキサートなど)を利用
DHFRはメトトレキサート結合時に高い立体安定性を持ち、ポリペプチド鎖が膜通過中でも折りたたまれて展開しづらくなります。この性質を利用し、メトトレキサートを添加してキメラタンパク質の完全な膜通過を人工的に停止させる。 - 段階的取り込みの停止
細胞もしくはミトコンドリア画分にキメラタンパク質を加え、メトトレキサート存在下で取り込みを進行、一定時間ごとに反応を停止する。 - シグナル配列切断の判定
反応後、タンパク質を回収してSDS-PAGEで分析し、シグナルペプチダーゼによるシグナル配列切断有無を調べる。N末端配列解析や特異的抗体を使った免疫ブロッティングも有効。 - コントロール実験
メトトレキサートを添加しない条件や、プロテアーゼ阻害剤を加えた条件も含めることで、切断時期と取り込み状態(膜を完全に通過した後に切断されるのか、輸送途中でも切断されるのか)を比較する。
期待される結果と解釈
- 完全な輸送が達成できず、DHFRで停止した状態でシグナル配列が切断されない場合:
シグナルペプチダーゼによる切断は、前駆体タンパク質がマトリックス内に完全に取り込まれた後にのみ起こると考えられる。 - DHFRで停止した状態でもシグナル配列の切断が認められる場合:
輸送途中でも一部がマトリックス内に露出していれば切断が起こることを示す。
このような実験により、シグナル配列切断が輸送完了と同時か、それ以前に始まるのかを明らかにすることができます。
ミトコンドリアや葉緑体への輸送では、それぞれの細胞小器官内でさらに複数の部位への選別が行われている。それらの部位の名称をあげよ。ミトコンドリアを例とし、ADP/ATP対向輸送体とシトクロム b2の場合を比較したとき、それらが固有の部位に送り込まれる際にどれだけ共通の機構を使っているかを示せ。
ミトコンドリア・葉緑体内の主な部位
ミトコンドリア
葉緑体
ADP/ATP対向輸送体とシトクロムb2の場合の比較
| タンパク質 | 固有の部位 | 初期の輸送共通機構 (TOM複合体) | 仕分け後の輸送経路 |
|---|---|---|---|
| ADP/ATP対向輸送体 | 内膜 | 使う | TOM通過→TIM22複合体で内膜へ |
| シトクロムb2系タンパク質 | 膜間腔 | 使う | TOM通過→TIM23複合体で内部へ→膜間腔へ選別される |
共通の機構
途中からの分岐
- ADP/ATP対向輸送体は「内膜のキャリアタンパク質」なので、TOM通過後はTIM22複合体を経て内膜に挿入されます。
- シトクロムb2(主に酵母では膜間腔局在)はTOM通過後、TIM23複合体を経て一度マトリックス側へ進入、その後選別シグナルによって膜間腔へリリースされます。
まとめ
- ミトコンドリアや葉緑体では、各オルガネラ内に複数の構造区画が存在し、分子的な「住所指定」によりタンパク質が正確に仕分けられます。
- 初期段階(TOM複合体通過)までは多くの前駆体タンパク質で共通した経路をとりますが、その後の構造区画への分配は、ターゲティングシグナルや専用トランスロケーター(TIM22, TIM23, SAM, MIAなど)の違いによって分岐します。
ペルオキシソームには酸素分子を使ってさまざまな基質を酸化する酵素が存在するが、その過程で過酸化水素が発生し、それは分解しなければならない。過酸化水素を分解する酵素の名前は何か.その酵素をペルオキシソームに送り込む機構とそのさいに結合するタンパク質はどのようなものか。
過酸化水素を分解する酵素の名前
- ペルオキシソームで過酸化水素を分解する主要な酵素はカタラーゼ(Catalase)です。カタラーゼは過酸化水素(H2O2H2O2)を水と酸素へと急速に分解し、細胞内での酸化ストレスを防ぐ役割を果たします。
ペルオキシソームへの酵素送り込み機構
- ペルオキシソームタンパク質は、細胞質で合成された後、特定の**ペルオキシソーム標的化シグナル(PTS)**を持つことで、ペルオキシソーム内へ移行します。
- 最も代表的なのはPTS1配列(C末端の3アミノ酸:Ser-Lys-Leu、SKLなど)で、多くの酵素(カタラーゼを含む)に見られます。
- PTS2配列(N末端近くの別の標的配列)をもつタンパク質もあります。
標的シグナルに結合するタンパク質
- ペルオキシソーム輸送時、ペルオキシン(PEX)ファミリーと呼ばれる輸送関連タンパク質が重要です。
- 具体的には、PEX5タンパク質がPTS1配列を持つ酵素(カタラーゼなど)に細胞質で結合し、ペルオキシソーム膜のトランスポーター複合体を介して内腔へタンパク質を送り込みます。
- PTS2の場合はPEX7などが輸送に関与します。
このようにカタラーゼはPTS1シグナルでPEX5を介してペルオキシソームに入り、そこで過酸化水素の分解を担い細胞の安全を守っています。
機能をもつペルオキシソームを失った新しい変異体を同定したとする。この変異体の欠陥がおもに膜の形成とタンパク質の埋め込みにあるのか、それともマトリックスタンパク質の取り込みにあるのかを実験的に決めるにはどうしたらよいかについて述べよ
実験的アプローチ
1. ペルオキシソーム構造(膜)の有無の観察
- 電子顕微鏡や蛍光顕微鏡で特異的な膜マーカー(例:ペルオキシソーム膜タンパク質PMP70やPex14など)に結合する抗体やGFP融合タンパク質を使い、ペルオキシソーム膜構造自体が存在するか調べる。
- 膜小器官が全く見られなければ、膜形成(あるいは膜タンパク質の挿入)に主な欠陥があると推定できる。
2. マトリックスタンパク質の取り込み評価
- ペルオキシソーム基質タンパク質(例:カタラーゼやPTS1-GFPなど)を発現させ、蛍光顕微鏡や免疫染色で分布を観察する。
- 膜自体は正常でマトリックスタンパク質だけが細胞質に分布していれば、基質タンパク質の取り込みに欠陥があると判断できる。
3. タンパク質輸送シグナル(PTS)の利用実験
- 基質のC末端にPTS1、N末端にPTS2シグナルを持つ蛍光タンパク質(GFPなど)を発現させ、正常細胞と変異体で局在の比較を行う。
- 両タイプがともに細胞質に局在→共通の取り込み機構欠損
- 膜タンパク質だけ局在消失→膜形成/挿入異常
4. 膜と基質タンパク質の両者を同時に免疫染色
まとめ
- 膜構造自体が消失していれば「膜形成もしくは膜タンパク質の埋め込み」異常、
- 膜は存在するが内腔に基質タンパク質が蓄積しない場合は「マトリックスタンパク質の取り込み」障害
- 蛍光タンパク質・免疫染色による局在観察が最も確実な実験指標となります。
本章で述べてきた多くの証拠から、膜を通り抜けてタンパク質を細胞小器官内に送り込むにはポリペプチド鎖内に特殊な配列が必要であることが明らかになった。40kDa以上のタンパク質の核への輸送もその点は同じで,核膜孔複合体を通って能動的に輸送されている、高分子を核へ特異的に輸送するために必要なアミノ酸配列にはどのような名前がつけられているか。そのさいに必要とされる3種類のタンパク質の名前をあげ、それらがどのように働くのかを簡単に述べよ。
1. 核へ特異的に輸送するために必要なアミノ酸配列の名前
2. 必要な3種類のタンパク質の名前と働き
- インポーチン(Importin)
細胞質でNLSを持つタンパク質に結合し、核膜孔複合体(NPC)を通過する際の輸送体として働く可溶性輸送受容体タンパク質です。
→ NLSタンパク質を認識して結合し、NPCを介して核内へ運びます。 - Ran(Ras-related Nuclear protein)
RanはGTP結合型とGDP結合型の間の状態変化によって輸送の方向性を制御し、インポーチンと基質の結合および解離を調節します。
→ 核内でRan-GTPがインポーチンと基質の解離を促進し、核内への一方向性輸送を可能にします。 - 核膜孔複合体(Nuclear Pore Complex, NPC)構成タンパク質
NPCは核膜を貫く巨大なタンパク質複合体であり、インポーチン-基質複合体がNPCを通過する際に物理的な通路と通行権を提供します。
このように、NLSというシグナル配列を持つタンパク質がインポーチンにより認識され、RanのGTPaseサイクルの調節を受けながら、NPCを通過して核へ能動的に輸送されます。
NES を含む積み荷タンパク質の一方向的輸送にとって、Ran-GAPの核局在性,およびRan-GEF の細胞質局在性がなぜ必要なのか。
核から細胞質へのタンパク質輸送やその逆の輸送では、Ranと呼ばれる低分子量Gタンパク質が重要な役割を果たします。RanはGTP結合型(活性型)とGDP結合型(不活性型)の間を切り替え、その状態によって輸送の方向性や cargos と輸送担体の結合・解離を制御しています。
- **Ran-GEF(Guanine nucleotide Exchange Factor)**は核内に存在し、Ran-GDPをRan-GTPに活性化します。これにより核内ではRanは主にGTP結合型となります。
- **Ran-GAP(GTPase-Activating Protein)**は細胞質に局在し、RanのGTPを加水分解してRan-GDPに変換します。細胞質ではRanはGDP結合型が優勢です。
この局在性の違いにより、Ran-GTPの核内での高濃度とRan-GDPの細胞質での高濃度という濃度勾配が作られます。
この濃度勾配は、以下のように一方向的輸送を可能にするエネルギー源の役割を果たします。
- 核内でRan-GTPが積み荷タンパク質と輸送体(エクスポーチンやインポーチンなど)複合体を解離させることで、核内への輸送や核外への輸送後のcargoの放出を促進します。
- 細胞質でRan-GDPが多いため、輸送体は積み荷と再び結合しにくくなり、輸送の方向性(核⇄細胞質)を維持します。
つまり、Ran-GAPの細胞質局在とRan-GEFの核局在が必須なのは、RanのGTP/GDP状態の局所的な違いを作り出し、そのエネルギー差を活用してタンパク質の核輸送のベクトルを制御しているからです。この濃度勾配なしには、タンパク質の一方向的な輸送は成立しません。
問題文引用元:東京化学同人 分子細胞生物学 第6版
コメント